
【题目】下列说法正确的是( )
A.![]() 的一溴代物和
的一溴代物和![]() 的一溴代物都有4种(不考虑立体异构)
的一溴代物都有4种(不考虑立体异构)
B.CH3CH=CHCH3分子中的四个碳原子在同一直线上
C.按系统命名法,化合物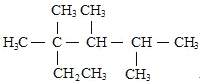 的名称是2,3,4-三甲基-2-乙基戊烷
的名称是2,3,4-三甲基-2-乙基戊烷
D.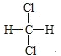 与
与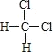 互为同分异构体
互为同分异构体
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】常温下,在体积均为20mL、浓度均为0.1mol·L-1的HX溶液、HY溶液中分别滴加同浓度的NaOH溶液,反应后溶液中水电离的c(H+)表示为pH水=-lgc(H+)水。pH水与滴加氢氧化钠溶液体积的关系如图所示。
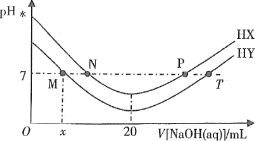
下列推断正确的是
A.HX的电离方程式为HX=H++X-
B.T点时c(Na+)=c(Y-)>c(H+)=c(OH-)
C.常温下用蒸馏水分别稀释N、P点溶液,pH都降低
D.常温下,HY的电离常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.乙烯中![]() 键的键能是乙烷中
键的键能是乙烷中![]() 键的键能的2倍
键的键能的2倍
B.氧气分子中含有1个![]() 键和1个
键和1个![]() 键
键
C.![]() 键的极性比
键的极性比![]() 键的极性大
键的极性大
D.![]() 中4个
中4个![]() 键的键能不相等
键的键能不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)乙二胺(![]() )是一种有机化合物,分子中氮、碳的杂化类型分别是__________、__________。。乙二胺能与
)是一种有机化合物,分子中氮、碳的杂化类型分别是__________、__________。。乙二胺能与![]() 、
、![]() 等金属离子形成稳定环状离子,其原因是__________,其中与乙二胺形成的化合物稳定性相对较高的是__________(填“
等金属离子形成稳定环状离子,其原因是__________,其中与乙二胺形成的化合物稳定性相对较高的是__________(填“![]() ”或“
”或“![]() ”)。
”)。
(2)![]() 中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的
中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的![]() 的结构式为__________,其中
的结构式为__________,其中![]() 的配位数为__________。
的配位数为__________。
(3)![]() 和
和![]() 与卤化氢的反应相似,产物的结构和性质也相似。下列对
与卤化氢的反应相似,产物的结构和性质也相似。下列对![]() 与
与![]() 反应产物的推断正确的是__________(填序号)。
反应产物的推断正确的是__________(填序号)。
a 不能与![]() 反应
反应
b 含离子键、共价键
c 能与水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[物质结构与性质]
[Zn(CN)4]2–在水溶液中与HCHO发生如下反应:
4HCHO+[Zn(CN)4]2–+4H++4H2O===[Zn(H2O)4]2++4HOCH2CN
(1)Zn2+基态核外电子排布式为____________________。
(2)1 mol HCHO分子中含有σ键的数目为____________mol。
(3)HOCH2CN分子中碳原子轨道的杂化类型是______________。
(4)与H2O分子互为等电子体的阴离子为________________。
(5)[Zn(CN)4]2–中Zn2+与CN–的C原子形成配位键。不考虑空间构型,[Zn(CN)4]2–的结构可用示意图表示为_____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
|
|
|
|
|
| |
熔点/℃ | -85.5 | 115.2 | >600 | -75.5 | 16.8 | 10.3 |
沸点/℃ | -60.3 | 444.6 | (分解) | -10.0 | 45.0 | 337.0 |
回答下列问题:
(1)根据价层电子对互斥理论,![]() 、
、![]() 、
、![]() 的气态分子中,中心原子价层电子对数不同于其他分子的是__________。
的气态分子中,中心原子价层电子对数不同于其他分子的是__________。
(2)气态三氧化硫以单分子形式存在,其分子的立体构型为__________形,其中共价键的类型有__________种;固体三氧化硫中存在如图所示的三聚分子,该分子中![]() 原子的杂化轨道类型为__________。
原子的杂化轨道类型为__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1HA溶液所得滴定曲线如图。下列说法不正确的是

A.HA的电离平衡常数Ka=10-5
B.点①所示的溶液中:2c(Na+)=c(A-)+c(HA)
C.点③所示的溶液中:c(HA)>c(OH-)-c(H+)
D.点④所示的溶液中:2c(OH-)-2c(H+)=c(A-)+3c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电动汽车(标志为“![]() ”)在改善城市交通、保护环境等方面的作用至关重要。下列说法不正确的是
”)在改善城市交通、保护环境等方面的作用至关重要。下列说法不正确的是
A. 电动汽车的使用有助于减少氮氧化物的排放
B. 燃油汽车也可以悬挂该标志
C. 电动汽车使用时涉及化学能与电能的转换
D. 电动汽车充电、放电过程均有电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁酸锌(ZnFe2O4)是对可见光敏感的半导体催化剂,其实验室制备原理为:
①ZnSO4+2FeSO4+3Na2C2O4+6H2O![]() ZnFe2(C2O4)3·6H2O↓+3Na2SO4
ZnFe2(C2O4)3·6H2O↓+3Na2SO4
②ZnFe2(C2O4)3·6H2O![]() ZnFe2O4+2CO2 ↑+4CO↑+6H2O
ZnFe2O4+2CO2 ↑+4CO↑+6H2O
回答下列问题:
(1)基态 Fe2+的价层电子排布图为___________.
(2)电离能大小比较:I1(Zn)___________ I1(Cu),I2(Zn)___________ I2 (Cu) (填“>”“<”或“=”)。
(3)Na2SO4 中阴离子的空间构型是___________,该离子中 S 的杂化类型是_____。
(4)CO和N2的分子结构相似,标准状况下,VLCO2和CO的混合气体中含键的物质的量为___________。与CO2互为等电子体的离子有____________(写一种即可)。
(5)ZnCl2、ZnBr2、ZnI2 的熔点依次为283℃、394℃、446℃,其主要原因是___________。
(6)铁和碳组成的某种晶体的晶胞如图所示。面心上铁原子相连构成正八面体。
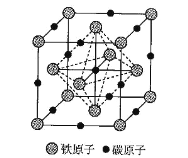
已知该晶体的密度为 dg·cm-3,NA 是阿伏加德罗常数的值。
①该晶体中Fe、C原子的最简比为___________。
②该晶胞中相邻两个面心上铁原子最近的核间距离 D=___________nm(只列计算式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com