


科目:高中化学 来源: 题型:阅读理解
 TiCl4(l)+O2 (g);△H=+151kJ/mol反应难于发生,所以工业上不能直接由TiO2和Cl2反应来制取TiCl4.当反应体系中加入碳后,反应分如下两步进行(如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热相同).
TiCl4(l)+O2 (g);△H=+151kJ/mol反应难于发生,所以工业上不能直接由TiO2和Cl2反应来制取TiCl4.当反应体系中加入碳后,反应分如下两步进行(如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热相同). TiCl4 (l)+2CO (g);△H=
TiCl4 (l)+2CO (g);△H= TiCl4(l)+O2 (g)顺利进行的原因是
TiCl4(l)+O2 (g)顺利进行的原因是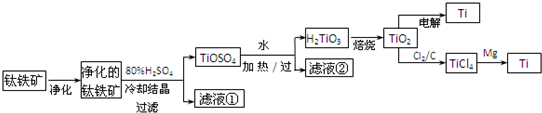
查看答案和解析>>
科目:高中化学 来源:2011-2012学年武汉市高三新起点调研测试化学试卷 题型:实验题
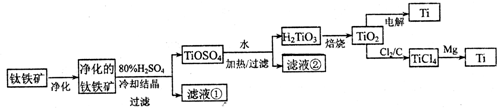
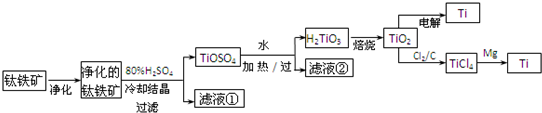
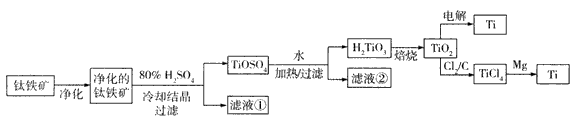
(11分)钛是一种重要的金属,工业上用钛铁矿(主要成分为FeTiO3 ,含FeO、Al2O3、SiO2 等杂质)为原料制钛白粉(TIO2 ) , TiO2常通过两种方法可制得 Ti。
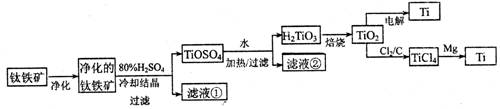
其中, 2H2SO4+ FeTiO3 = TiOSO4+ FeSO4+ 2H2O 。回答下列问题。
(l)净化钛矿石时,需用浓氢氧化钠溶液来处理,该过程中发生反应的化学方程式有:
SiO2+2NaOH =Na2SiO3 + H2O 和
(2)滤液①中的溶质主要是 FeSO4,检验其中Fe2+的方法是: .
(3)从 TiOSO4→H2TiO3需要加热,则加热的目的是: 。
(4)电解 TiO2来获得 Ti 是以 TiO2作阴极,石墨为阳极,熔融CaO为电解液,用碳块作电解槽池。其阴极反应的电极反应式为: .
(5)从化学平衡的角度解释:往TiO2和Cl2反应体系中加人焦炭后,能使反应 TIO2(s) + 2C12 (g) TICl4(l) +O2 (g)顺利进行的原因是:
TICl4(l) +O2 (g)顺利进行的原因是:
查看答案和解析>>
科目:高中化学 来源:武昌区模拟 题型:填空题



查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题
 TiCl4(l)+O2(g) △H=+151 kJ.mol-1难于发生,所以工业上不能直接由TiO2和
TiCl4(l)+O2(g) △H=+151 kJ.mol-1难于发生,所以工业上不能直接由TiO2和 TiCl4 (l) +2CO( g) △H2 则△H2=____。
TiCl4 (l) +2CO( g) △H2 则△H2=____。 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com