
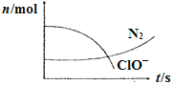
【题目】某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种离子。在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中不正确的是
A.还原剂是含CN-的物质,氧化产物不只有N2
B.氧化剂是ClO-,还原产物是HCO3-
C.参与反应的氧化剂与还原剂的物质的量之比为2:5
D.标准状况下若生成2.24LN2则转移电子为1mol
【答案】BC
【解析】
由图可知,ClO-是反应物、N2是生成物,结合元素守恒知,CN-为反应物、Cl-生成物,反应中C元素应该生成物HCO3-,根据元素守恒知水是反应物,根据原子守恒、电子守恒、电荷守恒配平方程式为5ClO-+2CN-+H2O=N2↑+5Cl-+2HCO3-,氧化剂是ClO-、还原剂是CN-,以此来解答。
A、还原剂是CN-,还原剂对应的产物是氧化产物,氧化产物是N2、HCO3-,故A正确;
B、氧化剂的ClO-,还原剂对应的产物是氧化产物,氧化产物是N2、HCO3-,故B错误;
C、氧化剂是ClO-、还原剂是CN-,其计量数之比等于物质的量之比,则氧化剂和还原剂的物质的量之比为5:2,故C错误;
D、标况下生成2.24L氮气时,其物质的量为0.1mol,生成0.1mol氮气同时还生成0.2molHCO3-,转移电子物质的量为0.1mol×2×[0-(-3)]+0.2mol×(4-2)=1mol,故D正确。
答案选BC。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列关于晶体的说法正确的组合是( )
①分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键
⑤CaTiO3晶体中(晶胞结构如图所示)每个钛原子和12个氧原子紧相邻

⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦晶体中分子间作用力越大,分子越稳定
⑧氯化钠熔化时离子键被破坏
A.①②③⑥B.①②④C.③⑤⑦D.③⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO是大气污染气体,可利用化学反应进行治理或转化。
(1)甲醇是重要的溶剂和燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为:CO(g)+2H2(g)![]() CH3OH(g) △H<0
CH3OH(g) △H<0
①T℃时,向容积为2L的恒容密闭容器中充入1 mol CO和1.2 mol H2,一段时间后达到平衡,此时H2与CH3OH的体积分数之比为2:5,该反应的平衡常数K=___________;此时若向容器中再通入0.4 mol CO和0.2 mol CH3OH(g),则平衡将___________移动。(填“向正反应方向”“不”或“向逆反应方向”)
②在一容积可变的密闭容器中充入一定物质的量的CO和H2,测得CO在不同温度下的平衡转化率与压强的关系如图所示。a、b、c三点平衡常数K(a)、K(b)、K(c)的大小关系是___________。b、d点的正反应速率vb(CO)_______va(CO).

(2)沥青混凝土可作为2CO(g)+O2(g)![]() 2CO2(g)反应的催化剂。图表示在相同的恒容密闭容器、相同起始浓度、反应相同的时间,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
2CO2(g)反应的催化剂。图表示在相同的恒容密闭容器、相同起始浓度、反应相同的时间,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
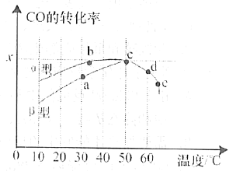
①a、b、c、d四点中表示平衡状态的是___________;
②e点转化率出现突变的原因可能是______________________。
(3)电解法转化CO2可实现CO2资源化利用。电解时CO2在阴极区转化为HCOOH,其原理示意图如下:

电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M是有机合成的重要中间体,制备M的一种合成路线如下(部分反应条件和试剂略去):
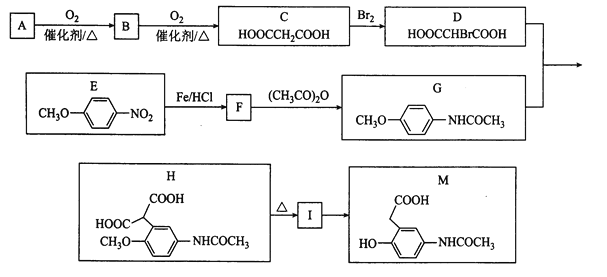
已知:①A的密度是相同条件下H2密度的38倍;其分子的核磁共振氢谱中有3组峰;
②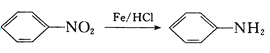 (-NH2容易被氧化);
(-NH2容易被氧化);
③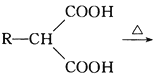 R-CH2COOH
R-CH2COOH
请回答下列问题:
(1)B的化学名称为______。A中官能团的电子式为______。
(2)C![]() D的反应类型是______,I的结构简式为______。
D的反应类型是______,I的结构简式为______。
(3)F![]() G的化学方程式为______。
G的化学方程式为______。
(4)M不可能发生的反应为______(填选项字母)。
a.加成反应 b.氧化反应 c.取代反应 d.消去反应
(5)请写出任意两种满足下列条件的E的同分异构体有______。
①能与FeCl3溶液发生显色反应 ②能与NaHCO3反应 ③含有-NH2
(6)参照上述合成路线,以![]() 为原料(无机试剂任选),设计制备
为原料(无机试剂任选),设计制备![]() 的合成路线:______。
的合成路线:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置(略去部分夹持仪器,气密性已检验)生产硫代硫酸钠晶体(Na2S2O3·5H2O)。实验步骤是先向装置①的烧瓶中滴加80%的浓H2SO4;充分反应后过滤装置③中混合物,滤液经结晶即得到产品。

已知:2Na2S+Na2SO3+3SO2=3Na2S2O3。下列判断不正确的是( )
A.应用装置①,利用H2O2和MnO2可制备少量O2
B.装置③中Na2S和Na2SO3的物质的量之比最好为1:2
C.实验过程中,装置②和装置④的作用相同
D.装置⑤中盛有NaOH溶液,可吸收多余的尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池可净化废水,同时还能获得能源或有价值的化学产品,图1为其工作原理,图2为废水中Cr2O72-离子浓度与去除率的关系。下列说法正确的是
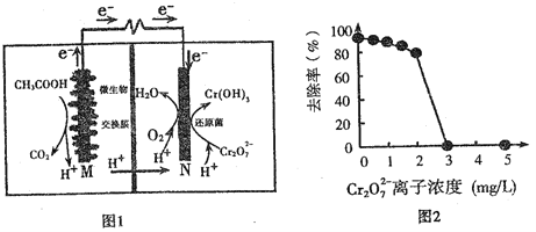
A. M为电池正极,CH3COOH被还原
B. 外电路转移4mol电子时,M 极产生22.4LCO2
C. 反应一段时间后,N极附近的溶液pH下降
D. Cr2O72-离子浓度较大时,可能会造成还原菌失活
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二氯丙烷(CH2ClCHClCH3)是一种重要的化工原料,工业上可用丙烯加成法制备,主要副产物为3-氯丙烯(CH2=CHCH2Cl),反应原理为:
I.CH2=CHCH3(g)+Cl2(g) ![]() CH2ClCHClCH3(g) H1=-134kJ·mol-1
CH2ClCHClCH3(g) H1=-134kJ·mol-1
II.CH2=CHCH3(g)+Cl2(g) CH2=CHCH2Cl(g)+HCl(g) H2=-102kJ·mol-1
请回答下列问题:
(1)已知CH2=CHCH2Cl(g)+HCl(g) ![]() CH2ClCHClCH3(g)的活化能Ea(正)为132kJ·mol-1,则该反应的活化能Ea(逆)为___________kJ·mol-1。
CH2ClCHClCH3(g)的活化能Ea(正)为132kJ·mol-1,则该反应的活化能Ea(逆)为___________kJ·mol-1。
(2)一定温度下,密闭容器中发生反应I和反应II,达到平衡后增大压强,CH2ClCHClCH3的产率____________(填“增大”“减小”或“不变”),理由是_________________________________。
(3)起始时向某恒容绝热容器中充入1 mol CH2=CHCH3和1 mol Cl2发生反应II,达到平衡时,容器内气体压强_________________(填“增大”“减小”或“不变”)。
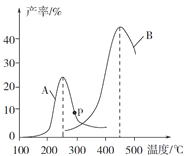
(4)某研究小组向密闭容器中充入一定量的CH2=CHCH3和Cl2,分别在A、B两种不同催化剂作用下发生反应,一段时间后测得CH2ClCHClCH3的产率与温度的关系如图所示。p点是否为对应温度下CH2ClCHClCH3的平衡产率,_________填“是”或“否”)判断理由是_______________________。
(5)一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和Cl2(g)。在催化剂作用下发生反应I,容器内气体的压强随时间的变化如下表所示。
时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
压强/kPa | 80 | 74.2 | 69.4 | 65.2 | 61.6 | 57.6 | 57.6 |
①用单位时间内气体分压的变化来表示反应速率,即![]()
②该温度下,若平衡时HCl的体积分数为![]() ,则丙烯的平衡总转化率
,则丙烯的平衡总转化率![]() ____________;反应I的平衡常数Kp=____________________kPa-1(Kp为以分压表示的平衡常数,保留小数点后2位)。
____________;反应I的平衡常数Kp=____________________kPa-1(Kp为以分压表示的平衡常数,保留小数点后2位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是德国化学家李比希1831年测定烃类化合物(只含C、H两种元素)组成的装置。瓷舟内的烃样品经加热分解或气化后用纯![]() 流驱赶经过灼热的
流驱赶经过灼热的![]() ,这里烃类化合物反应变成
,这里烃类化合物反应变成![]() 和
和![]() ,经吸收管吸收。
,经吸收管吸收。
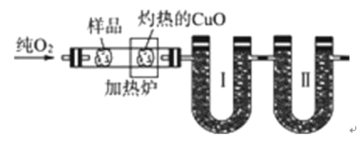
已知下表数据:
瓷舟 | 吸收管Ⅰ | 吸收管Ⅱ | |||
瓷舟 | 样品+瓷舟 | 吸收前 | 吸收后 | 吸收前 | 吸收后 |
A | B | C | D | E | F |
(1)烃样品在反应过程中所用的氧化剂是________________________;
(2)吸收管Ⅰ应装的吸收剂是____________,吸收管Ⅱ应装的吸收剂是____________;
(3)样品中碳的质量分数的数学表达式是________________________;
(4)取该烃![]() 在氧气中充分燃烧后,生成
在氧气中充分燃烧后,生成![]() 和
和![]() 。若该烃在一定条件下能与氯气发生取代反应,且其一氯代物只有一种,则烃A的结构简式为___________,用系统命名法命名为____________。
。若该烃在一定条件下能与氯气发生取代反应,且其一氯代物只有一种,则烃A的结构简式为___________,用系统命名法命名为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铬具有极高的硬度和力学强度、优异的抗腐蚀性能和高温稳定性能,因而具有广泛应用前景。实验室制备CrN 反应原理为 CrCl3 +NH3![]() CrN+3HCl,装置如图所示
CrN+3HCl,装置如图所示
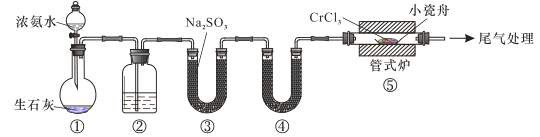
下列说法错误的是
A.装置①还可以用于制取O2、Cl2、CO2等气体
B.装置②、④中分别盛装NaOH溶液、KOH固体
C.装置③中也可盛装维生素c,其作用是除去氧气
D.装置⑤ 中产生的尾气冷却后用水吸收得到纯盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com