
”¾ĢāÄæ”æĻĀĶ¼ÖŠ¢Ł”«¢įŹĒŌŖĖŲÖÜĘŚ±ķÖŠµÄĒ°ĖÄÖÜĘŚĻąÓ¦µÄŌŖĖŲ£¬Ēė“ÓÖŠŃ”ŌńŗĻŹŹµÄŌŖĖŲ»Ų“šĪŹĢā£ŗ
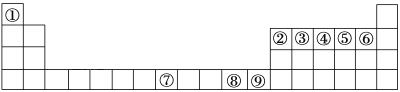
(1)øł¾ŻŌŖĖŲŌ×ÓµÄĶāĪ§µē×ÓÅŲ¼ĢŲÕ÷£¬ŌŖĖŲÖÜĘŚ±ķæÉ»®·ÖĪŖĪåøöĒųÓņ£¬¢ŁŌŖĖŲĪ»ÓŚÖÜĘŚ±ķµÄ________Ēų”£ŌŖĖŲ¢įµÄ¼Ūµē×ÓÅŲ¼Ź½ĪŖ___________”£
(2)¢Ś”¢¢ŽĮ½ŌŖĖŲŠĪ³ÉµÄ»ÆŗĻĪļµÄĮ¢Ģå¹¹ŠĶĪŖ________£¬ĘäÖŠŠÄŌ×ÓµÄŌӻƹģµĄĄąŠĶĪŖ____________”£
(3)ŌŖĖŲ¢ßÓėCOæÉŠĪ³ÉX(CO)5ŠĶ»ÆŗĻĪļ£¬øĆ»ÆŗĻĪļ³£ĪĀĻĀ³ŹŅŗĢ¬£¬ČŪµćĪŖ-20.5 ”ę£¬·ŠµćĪŖ103 ”ę£¬Ņ×ČÜÓŚ·Ē¼«ŠŌČܼĮ£¬¾Ż“ĖæÉÅŠ¶ĻøĆ»ÆŗĻĪļ¾§ĢåŹōÓŚ_______¾§Ģå(Ģī¾§ĢåĄąŠĶ)”£ŌŖĖŲ¢ßµÄĪ“³É¶Ōµē×ÓŹżĪŖ_____øö”£
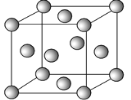
(4)ŌŖĖŲ¢ąµÄ¶ž¼ŪŃōĄė×ÓÓė¹żĮæµÄ¢ÜµÄĒā»ÆĪļµÄĖ®»ÆĪļ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ_____”£ŌŖĖŲ¢ąµÄµ„ÖŹµÄ¾§°ū½į¹¹ČēĶ¼£ŗŅŃÖŖ¾§°ūµÄĄā³¤ĪŖa cm£¬NAĪŖ°¢·ü¼ÓµĀĀŽ³£Źż£¬ŌņøĆ¾§ĢåµÄĆܶČĪŖ______g/cm3(ÓĆa”¢NA±ķŹ¾)”£
”¾“š°ø”æs 3d104s2 Ę½ĆęÕżČż½ĒŠĪ sp2ŌÓ»Æ ·Ö×Ó 4 Cu2£«£«4NH3”¤H2O=[Cu(NH3)4]2£«£«4H2O ![]()
”¾½āĪö”æ
øł¾ŻŌŖĖŲÖÜĘŚ±ķµÄĪ»ÖĆ£¬¢ŁĪŖH”¢¢ŚĪŖB”¢¢ŪĪŖC”¢¢ÜĪŖN”¢¢ŻĪŖO”¢¢ŽĪŖF”¢¢ßĪŖFe”¢¢ąĪŖCu”¢¢įĪŖZn£¬½įŗĻĪļÖŹ½į¹¹ŗĶ¾§°ūµÄ¼ĘĖć·½·Ø·ÖĪö½ā“š”£
(1)¢ŁĪŖH£¬×īĶā²ćÖ»ÓŠŅ»øöµē×Ó£¬Ī»ÓŚsĒų£»ŌŖĖŲ¢įĪŖZn£¬ĪŖ30ŗÅŌŖĖŲ£¬¼Ūµē×ÓÅŲ¼Ź½ĪŖ3d104s2£¬¹Ź“š°øĪŖ£ŗs£»3d104s2£»
(2)¢Ś”¢¢ŽĮ½ŌŖĖŲŠĪ³ÉµÄ»ÆŗĻĪļĪŖBF3£¬BŠĪ³É3øö¦Ņ¼ü£¬¹Ā¶Ōµē×ÓŹżĪŖ=![]() =0£¬B²ÉÓĆsp2Ōӻƣ¬BF3Į¢Ģå¹¹ŠĶĪŖĘ½ĆęÕżČż½ĒŠĪ£¬¹Ź“š°øĪŖ£ŗĘ½ĆęÕżČż½ĒŠĪ£» sp2Ōӻƣ»
=0£¬B²ÉÓĆsp2Ōӻƣ¬BF3Į¢Ģå¹¹ŠĶĪŖĘ½ĆęÕżČż½ĒŠĪ£¬¹Ź“š°øĪŖ£ŗĘ½ĆęÕżČż½ĒŠĪ£» sp2Ōӻƣ»
(3)ŌŖĖŲ¢ßÓėCOæÉŠĪ³ÉFe(CO)5ŠĶ»ÆŗĻĪļ£¬øĆ»ÆŗĻĪļ³£ĪĀĻĀ³ŹŅŗĢ¬£¬ČŪ·Šµć½ĻµĶ£¬·ūŗĻ·Ö×Ó¾§ĢåµÄĢŲÕ÷£»ĢśĪŖ26ŗÅŌŖĖŲ£¬µē×ÓÅŲ¼Ź½ĪŖ1s22s22p63s23p63d64s2£¬3dÉĻÓŠ4øöĪ“³É¶Ōµē×Ó£¬¹Ź“š°øĪŖ£ŗ·Ö×Ó£»4£»
(4)ŌŖĖŲ¢ąµÄ¶ž¼ŪŃōĄė×ÓĪŖCu2+£¬¢ÜµÄĒā»ÆĪļµÄĖ®»ÆĪļĪŖNH3H2O£¬Cu2+Óė¹żĮæNH3H2O·“Ó¦£¬Éś³ÉÅäĄė×Ó[Cu(NH3)4]2+ŗĶĖ®£¬ĘäĄė×Ó·½³ĢŹ½ĪŖ£ŗCu2++4NH3H2OØT[Cu(NH3)4]2++4H2O£»¾§°ūÖŠĶŌ×ÓŹżÄæ=8”Į![]() +6”Į
+6”Į![]() =4£¬¾§°ūÖŹĮæ=
=4£¬¾§°ūÖŹĮæ=![]() g£¬¾§°ūĢå»ż=a3cm3£¬ŌņøĆ¾§ĢåµÄĆܶČ
g£¬¾§°ūĢå»ż=a3cm3£¬ŌņøĆ¾§ĢåµÄĆܶČ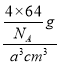 =
=![]() g/cm3£¬¹Ź“š°øĪŖ£ŗCu2++4NH3H2OØT[Cu(NH3)4]2++4H2O£»
g/cm3£¬¹Ź“š°øĪŖ£ŗCu2++4NH3H2OØT[Cu(NH3)4]2++4H2O£»![]() ”£
ӣ



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”潫3.84 gµÄĶ¼ÓČė100 mL H2SO4ŗĶHNO3»ģŗĻŅŗÖŠ£¬ĶČ«²æČܽā²¢·Å³öĪŽÉ«ĘųĢ唣ĻņČÜŅŗÖŠ¼ÓČė2.70 gĀĮ·Ū£¬³ä·Ö·“Ó¦ŗó¹żĀĖ£¬µĆµ½ČÜŅŗX”¢ĀĖŌüYŗĶĘųĢåZ£¬ĘųĢåZÓöæÕĘų²»±äÉ«£¬ŌŚ±ź×¼×“æöĻĀµÄĢå»żĪŖ672 mL”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A. ČܽāĀĮ·ŪµÄÖŹĮæĪŖ0.54 g
B. ĀĖŌüYÖŠæÉÄÜÖ»ŗ¬ÓŠCu
C. Ō»ģŗĻŅŗÖŠµÄc(H2SO4):c(HNO3)£½9:4
D. ČōĻņČÜŅŗXÖŠ¼ÓČė100 mL 2.0 mol”¤L£1ĒāŃõ»ÆÄĘČÜŅŗ£¬³ä·Ö·“Ó¦£¬ĖłµĆ³ĮµķĪŖ4.68 g
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅ»¶ØĪĀ¶Č”¢Ģå»żµÄĆܱÕČŻĘ÷ÖŠ£¬æÉÄę·“Ó¦A(s)+3B(g)![]() 2C(g)“ļµ½Ę½ŗāŹ±£¬ĻĀĮŠĖµ·ØÄÜÅŠ¶ĻøĆ·“Ó¦“ļµ½Ę½ŗāµÄŹĒ£Ø £©
2C(g)“ļµ½Ę½ŗāŹ±£¬ĻĀĮŠĖµ·ØÄÜÅŠ¶ĻøĆ·“Ó¦“ļµ½Ę½ŗāµÄŹĒ£Ø £©
¢ŁCµÄÉś³ÉĖŁĀŹŗĶCµÄ·Ö½āĖŁĀŹĻąµČ
¢Śµ„Ī»Ź±¼äÄŚÉś³ÉamolA£¬Ķ¬Ź±Éś³É3amolB
¢Ū»ģŗĻĘųĢåµÄĆÜ¶Č²»ŌŁ±ä»Æ
¢Ü»ģŗĻĘųĢåµÄ×ÜŃ¹Ēæ²»ŌŁ±ä»Æ
¢ŻA”¢B”¢CĪļÖŹµÄĮæÖ®±ČĪŖ1”Ć3”Ć2
¢Ž»ģŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ²»±ä
¢ßČŻĘ÷ÖŠCµÄĢå»ż·ÖŹż²»±ä
A.¢Ś¢Ü¢Ż¢ßB.¢Ł¢Ū¢Ü¢Ž¢ßC.¢Ł¢Ü¢Ž¢ßD.¢Ł¢Ū¢Ü¢Ż
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ”°Čķµē³Ų”±²ÉÓĆŅ»Õű”²ćÖ½Ę¬×÷ĪŖ“«µ¼Ģ壬Ņ»Ćę¶ĘZn£¬ĮķŅ»Ćę¶ĘMnO2”£µē³Ų×Ü·“Ó¦ĪŖZn+2MnO2+H2O=2MnO(OH)+ZnO”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
A.øƵē³ŲµÄÕż¼«ĪŖZnO
B.Znµē¼«ø½½üČÜŅŗµÄpH²»±ä
C.µē³ŲÕż¼«µÄµē¼«·“Ó¦ĪŖ2MnO2+2e-+2H2O=2MnO(OH)+2OH-
D.µ±0.1molZnĶźČ«ČܽāŹ±£¬Į÷¾µē½āŅŗµÄµē×ÓµÄĪļÖŹµÄĮæĪŖ0.2mol
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓŠ»śĪļÖÖĄą·±¶ą£¬½į¹¹ø“ŌÓ”£
£Ø1£©ĻĀĮŠø÷Ķ¼¾łÄܱķŹ¾¼×ĶéµÄ·Ö×Ó½į¹¹£¬ĘäÖŠ¼×ĶéµÄĒņ¹÷Ä£ŠĶŹĒ__(ĢīŠņŗÅ£¬ĻĀĶ¬)£¬±ķĻÖ¼×ĶéµÄæÕ¼äÕꏵ½į¹¹ŹĒ__”£


£Ø2£©ĻĀĮŠÓŠ»śĪļÖŠĖłÓŠŌ×ÓæÉŅŌŌŚĶ¬Ņ»øöĘ½ĆęÉĻµÄŹĒ___£ØĢīŠņŗÅ£©

£Ø3£©ČēĶ¼ŹĒÓÉ4øöĢ¼Ō×Ó½įŗĻ³ÉµÄ6ÖÖÓŠ»śĪļ(ĒāŌ×Óƻӊ»³ö)

¢ŁÉĻŹöÓŠ»śĪļÖŠÓė(c)»„ĪŖĶ¬·ÖŅģ¹¹ĢåµÄŹĒ__(ĢīŠņŗÅ)”£
¢ŚŠ“³öÓŠ»śĪļ(a)µÄĆū³Ę__”£
¢ŪÓŠ»śĪļ(a)ÓŠŅ»ÖÖĶ¬·ÖŅģ¹¹Ģ壬ŹŌŠ“³öĘä½į¹¹¼ņŹ½__”£
¢ÜŠ“³öÓė(c)»„ĪŖĶ¬ĻµĪļµÄ×ī¼ņµ„ÓŠ»śĪļŗĶäåĖ®·“Ó¦µÄ»Æѧ·½³ĢŹ½£ŗ__£»Éś³ÉĪļµÄĆū³ĘŹĒ___”£
£Ø4£©Ä³µ„Ļ©ĢžÓėĒāĘų¼Ó³ÉŗóÉś³ÉŅģĪģĶ飬øĆĻ©ĢžµÄ½į¹¹¼ņŹ½ÓŠ__ÖÖ”£
£Ø5£©”°Į¢·½Ķé”±ŹĒŅ»ÖÖŠĀŗĻ³ÉµÄĢž£¬Ęä·Ö×ÓĪŖÕż·½Ģå½į¹¹”£ČēĶ¼±ķŹ¾Į¢·½Ķé£¬Õż·½ĢåµÄĆæøö¶„µćŹĒŅ»øöĢ¼Ō×Ó£¬ĒāŌ×Ó¾łŹ”ĀŌ£¬Ņ»Ģõ¶ĢĻß±ķŹ¾Ņ»øö¹²ÓƵē×Ó¶Ō”£Ģ¼Ō×ÓÉĻµÄ¶žøöĒāŌ×Ó±»°±»ł£Ø-NH2£©Č”“ś£¬Ķ¬·ÖŅģ¹¹ĢåµÄŹżÄæÓŠ_ÖÖ”£
![]()
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚŅ»¶ØĢõ¼žĻĀ£¬¶ŌÓŚĆܱÕČŻĘ÷ÖŠ½ųŠŠµÄæÉÄę·“Ó¦A(g)+ 3B(g)![]() 2C(g)£¬ ĻĀĮŠĖµ·ØÄÜÖ¤Ć÷ÕāŅ» ·“Ó¦ŅŃ¾“ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄŹĒ
2C(g)£¬ ĻĀĮŠĖµ·ØÄÜÖ¤Ć÷ÕāŅ» ·“Ó¦ŅŃ¾“ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄŹĒ
A.Éś³ÉCµÄĖŁĀŹÓė·Ö½āCµÄĖŁĀŹĻąµČ.
B.A. B”¢CµÄ·Ö×ÓŹżÖ®±ČĪŖ1:3:2
C.A”¢B”¢CµÄÅضČĻąµČ
D.µ„Ī»Ź±¼äĻūŗÄnmolA£¬Ķ¬Ź±Éś³É2nmolC
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅ»¶ØĢõ¼žĻĀ“ęŌŚ·“Ó¦£ŗ2SO2(g)+ O2(g)![]() 2SO3(g)£¬”÷H£¼0”£ĻÖÓŠČżøöĢå»żĻąĶ¬µÄĆܱÕČŻĘ÷¢ń”¢¢ņ”¢¢ó£¬²¢ŌŚ400”ęĢõ¼žĻĀæŖŹ¼·“Ó¦£¬“ļµ½Ę½ŗāŹ±£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ(””””)
2SO3(g)£¬”÷H£¼0”£ĻÖÓŠČżøöĢå»żĻąĶ¬µÄĆܱÕČŻĘ÷¢ń”¢¢ņ”¢¢ó£¬²¢ŌŚ400”ęĢõ¼žĻĀæŖŹ¼·“Ó¦£¬“ļµ½Ę½ŗāŹ±£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ(””””)

A. ČŻĘ÷I”¢¢óÖŠĘ½ŗā³£ŹżĻąĶ¬
B. ČŻĘ÷II”¢¢óÖŠÕż·“Ó¦ĖŁĀŹŹ¼ÖÕĻąĶ¬
C. ČŻĘ÷¢ņ”¢¢óÖŠµÄ·“Ó¦“ļĘ½ŗāŹ±£¬SO3µÄĢå»ż·ÖŹż£ŗII<III
D. ČŻĘ÷IÖŠSO2µÄ×Ŗ»ÆĀŹÓėČŻĘ÷¢ņÖŠSO3µÄ×Ŗ»ÆĀŹÖ®ŗĶŠ”ÓŚ1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠÓŠ¹Ųµē½āÖŹČÜŅŗµÄĖµ·ØÕżČ·µÄŹĒ
A. Ļņ0.1mol/LCH3COOHČÜŅŗÖŠ¼ÓČėÉŁĮæĖ®£¬ČÜŅŗÖŠc(H+)/c(CH3COOH)¼õŠ”
B. ½«CH3COONaČÜŅŗ“Ó20”ęÉżĪĀÖĮ30”ę£¬ČÜŅŗÖŠc(CH3COO-)/c(CH3COOH)”¤c(OH£)Ōö“ó
C. ĻņŃĪĖįÖŠ¼ÓČė°±Ė®ÖĮÖŠŠŌ£¬ČÜŅŗÖŠc(NH4+)/c(Cl£)£¾1
D. ĻņAgCl”¢AgBrµÄ±„ŗĶČÜŅŗÖŠ¼ÓČėÉŁĮæĻõĖįŅų£¬ČÜŅŗÖŠc(Cl£)/c(Br£)²»±ä
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚĆܱÕČŻĘ÷ÖŠ£¬Ź¹2molN2ŗĶ6molH2»ģŗĻ·¢ÉśĻĀĮŠ·“Ó¦£ŗ
N2£Øg£©+3H2£Øg£©![]() 2NH3£Øg£© ¦¤H<0
2NH3£Øg£© ¦¤H<0
£Ø1£©µ±·“Ó¦“ļµ½Ę½ŗāŹ±£¬ N2ŗĶH2µÄ×Ŗ»ÆĀŹ±ČŹĒ ”£
£Ø2£©µ±“ļµ½Ę½ŗāŹ±£¬½«c(N2)”¢c(H2)”¢c(NH3)Ķ¬Ź±¼õŠ”Ņ»±¶£¬Ę½ŗā½«Ļņ ŅĘ¶Æ£ØĢī”°Ļņ×ó”±”¢”°ĻņÓŅ”±»ņ”°²»”±£©”£
£Ø3£©µ±“ļµ½Ę½ŗāŹ±£¬³äČėė²Ęų£¬²¢±£³ÖŃ¹Ēæ²»±ä£¬Ę½ŗā½«Ļņ___________ŅĘ¶Æ”£
£Ø4£©ČōČŻĘ÷ŗćČŻ”¢¾ųČČ£¬¼ÓČČŹ¹ČŻĘ÷ÄŚĪĀ¶ČŃøĖŁÉżÖĮŌĄ“µÄ2±¶£¬Ę½ŗā½«___________ŅĘ¶Æ£ØĢī”°Ļņ ×ó”±”¢”°ĻņÓŅ”±»ņ”°²»”±£©”£“ļµ½ŠĀĘ½ŗāŗó£¬ČŻĘ÷ÄŚĪĀ¶Č £ØĢī”°“óÓŚ”±”¢”°Š”ÓŚ”±»ņ”°µČÓŚ”±£©ŌĄ“µÄ2±¶”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com