
| A. | 加入少量浓盐酸 | B. | 加入几滴氯化铜溶液 | ||
| C. | 加入适量蒸馏水 | D. | 加入适量的氯化钠溶液 |
分析 过量的锌片,盐酸完全反应,则加快反应速率又不影响生成氢气的总量,可增大氢离子浓度或增大金属的接触面积、构成原电池等,不改变其氢离子物质的量即可,以此来解答.
解答 解;A.加入适量浓度较大的盐酸,氢离子浓度增大,反应速率增大,但稀盐酸物质的量增大,所以生成氢气总量增大,故A错误;
B.加入氯化铜溶液,Zn置换出Cu,Zn、Cu和稀盐酸构成原电池而加快反应速率,且稀盐酸物质的量不变,所以生成氢气总量不变,故B正确;
C.加入适量蒸馏水,浓度减小,反应速率减小,故C错误;
D.加入适量的氯化钠溶液,溶液体积增大,浓度减小,反应速率减小,故D错误.
故选B.
点评 本题考查外界条件对化学反应速率影响,为高频考点,明确外界条件对化学反应速率影响原理是解本题关键,注意把握题中锌过量的要求,难度不大.


 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 用98%的浓硫酸替代稀硫酸 | B. | 降低温度 | ||
| C. | 用铝粉代替铝片 | D. | 加入Na2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
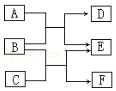 物质A~F都是初中化学中的常见物质,其中物质A是一种酸,物质C是一种盐,它们有如图所示的转化关系.反应①为A+B=D+E,反应②为B+C=E+F
物质A~F都是初中化学中的常见物质,其中物质A是一种酸,物质C是一种盐,它们有如图所示的转化关系.反应①为A+B=D+E,反应②为B+C=E+F查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能全部透过半透膜 | |
| B. | 能产生丁达尔效应 | |
| C. | 所得液体一定能导电 | |
| D. | 所得混合物不稳定,静置后容易产生沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
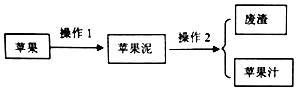
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2(SO4)3可以除去酸性废水中的悬浮颗粒 | |
| B. | 高锰酸钾溶液和双氧水进行环境消毒时原理是相同的 | |
| C. | 雾霾中含有大量超标的主要物质是SO2 | |
| D. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
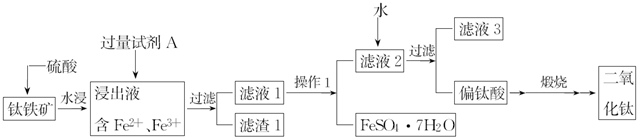
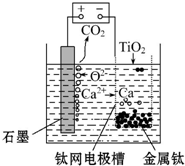
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁跟盐酸的反应:Fe+2H+═Fe3++H2↑ | |
| B. | 氯化铵固体和熟石灰共热:NH4++OH═-NH3↑+H2O | |
| C. | 向碳酸钙中加入盐酸:CO32-+2H+═H2O+CO2↑ | |
| D. | 氯化铁溶液和氢氧化钠溶液的反应:Fe3++3OH-═Fe(OH)3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com