
| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.54×105 | 1.88×103 |
分析 (1)热化学方程式表达的意义为:当2mol A2和1mol B2完全反应时,放出热量为akJ,而该反应为可逆反应,加入的2mol不能完全转化;
(2)正反应为放热反应,升高温度平衡逆向移动,平衡常数减小;
若在原来的容器中,只加入2mol C3,与加入2mol A2和1mol B2建立完全相同的平衡状态,平衡时C3的浓度相等,则a=b+c;
(3)在相同条件下要得到2a KJ热量,则参加反应的A2应4mol,结合可逆反应不能完全转化判断;
(4)A.及时分离出C3气体,反应速率减慢;
B.适当升高温度,平衡逆向移动;
C.增大B2的浓度,加快反应速率,平衡正向移动;
D.选择高效的催化剂不影响平衡移动;
(5)恒温恒容下,正反应为气体物质的量减小的反应,平衡时压强减小,若将上述容器改为恒压容器(反应前体积相同),起始时加入2mol A2和1mol B2,等效为在原平衡的基础上增大压强,反应物转化率增大;
(6)保持同一反应温度,在相同容器中,将起始物质改为4mol A2、2mol B2,等效为在原平衡的基础上增大压强.
解答 解:(1)热化学方程式表达的意义为:当2mol A2和1mol B2完全反应时,放出热量为akJ,而该反应为可逆反应,而加入2mol A2和1mol B2达到平衡时,没有完全反应,释放的热量小于完全反应释放的热量,即a>b,故答案为:>;
(2)正反应为放热反应,升高温度平衡逆向移动,平衡常数减小,故温度表中T1<T2;
若在原来的容器中,只加入2mol C3,与加入2mol A2和1mol B2建立完全相同的平衡状态,平衡时C3的浓度相等,即则C3的浓度=x mol•L-1,则a=b+c,
故答案为:<;=;a=b+c;
(3)在相同条件下要得到2a KJ热量,则参加反应的A2应4mol,可逆反应不能完全转化,故A2的起始物质的量应大于4mol,选项中只有D符合,
故选:D;
(4)A.及时分离出C3气体,平衡正向移动,但反应速率减慢,故A错误;
B.适当升高温度,提供反应速率,正反应为放热反应,平衡逆向移动,故B错误
C.增大B2的浓度,加快反应速率,平衡正向移动,故C正确;
D.选择高效的催化剂加快反应速率,但不影响平衡移动,故D错误,
故选:C;
(5)恒温恒容下,正反应为气体物质的量减小的反应,平衡时压强减小,若将上述容器改为恒压容器(反应前体积相同),起始时加入2mol A2和1mol B2,等效为在原平衡的基础上增大压强,反应物转化率增大,生成C3比恒容时多,则放出的热量也多,故d>b,
故答案为:>;由于恒压容器中压强比恒容容器中的大,故反应物的转化率较高,生成C3比恒容时多,则放出的热量也多;
(6)保持同一反应温度,在相同容器中,将起始物质改为4mol A2、2mol B2,等效为在原平衡的基础上增大压强,平衡正向移动,则平衡时A2的转化率变大,
故答案为:变大.
点评 本题考查化学平衡计算、化学平衡影响因素等,注意利用等效思想分析解答,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )甲酯并计算其产率.实验步骤如下:
)甲酯并计算其产率.实验步骤如下: 水形成的共沸物,其沸点为85℃;该实验中加入甲苯,易将水蒸出),再小心地加入5mL浓硫酸,摇动混匀后加入1~2粒沸石,组装好实验装置,在85~95℃下恒温加热反应1.5小时:
水形成的共沸物,其沸点为85℃;该实验中加入甲苯,易将水蒸出),再小心地加入5mL浓硫酸,摇动混匀后加入1~2粒沸石,组装好实验装置,在85~95℃下恒温加热反应1.5小时:| 名称 | 分子量 | 颜色状态 | 相对密度 | 熔点(℃) | 沸点(℃) |
| 水杨酸甲酯 | 152 | 无色液体 | 1.18 | -8.6 | 224 |
| 水杨酸 | 138 | 白色晶体 | 1.44 | 158 | 210 |
| 甲醇 | 32 | 无色液体 | 0.792 | -97 | 64.7 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
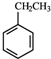 (g)+CO2(g)?
(g)+CO2(g)?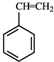 (g)+CO(g)+H2O(g)△H=-166KJ/mol
(g)+CO(g)+H2O(g)△H=-166KJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数大于4的元素可能是金属元素 | |
| B. | 含有共价键的物质一定是共价化合物 | |
| C. | 离子化合物中只可能含有离子键而不可能含有共价键 | |
| D. | 多种非金属元素之间形成的共价键一定是极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2的电子式: | B. | C2H4的结构式:CH2=CH2 | ||
| C. | 硫原子结构示意图: | D. | 乙醇的分子式:C2H6O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com