
分析 用软锰矿制备KMnO4晶体,由反应原理可知,将软锰矿与固体KOH在高温下通入O2共熔后,溶解、过滤后,对滤液用硫酸酸化,再浓缩、结晶即可,以此来解答.
解答 解:由反应原理可知,实验室用软锰矿制备KMnO4晶体的实验步骤:将软锰矿与固体KOH在高温下通入O2共熔,充分反应,再冷却,加蒸馏水溶解,滤去残渣;将滤液用硫酸酸化,滤去MnO2沉淀;加热浓缩,冷却结晶(过滤,洗涤,低温烘干)[或冷却,加硫酸溶解,过滤去残渣和MnO2沉淀;加热浓缩滤液,冷却结晶(过滤,洗涤,低温烘干)],
故答案为:冷却,加蒸馏水溶解,滤去残渣;将滤液用硫酸酸化,滤去MnO2沉淀,加热浓缩,冷却结晶(过滤,洗涤,低温烘干)[或冷却,加硫酸溶解,过滤去残渣和MnO2沉淀;加热浓缩滤液,冷却结晶(过滤,洗涤,低温烘干)].
点评 本题考查物质的制备实验方案设计,为高频考点,把握反应原理、实验技能为解答的关键,侧重分析与实验能力的考查,注意信息的应用,题目难度不大.


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:选择题
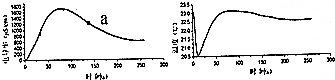
| A. | 冰醋酸稀释过程中,溶液的导电能力先增大后减小 | |
| B. | 左图的曲线也可以表示溶液的pH变化趋势 | |
| C. | 稀释一开始,溶液的温度就下降,可推知电离过程可能是吸热过程 | |
| D. | 可通过微热的方法,使图中a点溶液中的c(CH3COO-)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盖斯定律实质上是能量守恒定律的体现 | |
| B. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| C. | 由C(石墨,s)═C(金刚石,s)△H=+1.9 kJ/mol,可知石墨比金刚石稳定 | |
| D. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜片投入FeCl3溶液中:3Cu+2Fe3+═2Fe+3Cu2+ | |
| B. | AgCl悬浮液中加入Na2S溶液沉淀变黑:2AgCl+S2-═Ag2S+2Cl- | |
| C. | 用两根铁电极电解CuSO4溶液:2Cu 2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu↓+O2↑+4H+ | |
| D. | Ca(HCO3)2溶液中加入澄清石灰水:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
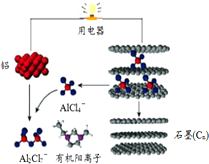 斯坦福大学华人化学家戴宏杰率领的团队研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
斯坦福大学华人化学家戴宏杰率领的团队研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )| A. | 充电时,该电池负极应连接外接电源的负极 | |
| B. | 放电时,电子从铝流出经过电解质溶液到达石墨电极 | |
| C. | 充电时的阳极反应为:Cn+AlCl4--e-═CnAlCl4 | |
| D. | 放电时的负极反应为:Al-3e-+7AlCl4-═4Al2Cl7- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
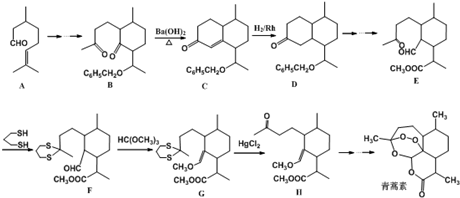
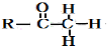 +
+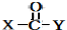 $\stackrel{O{H}^{-}}{→}$
$\stackrel{O{H}^{-}}{→}$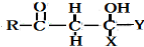
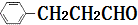 )的路线流程图.路线流程图示例如下:
)的路线流程图.路线流程图示例如下: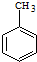 $→_{光}^{Cl_{2}}$
$→_{光}^{Cl_{2}}$ 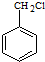 $→_{△}^{NaOH/H_{2}O}$
$→_{△}^{NaOH/H_{2}O}$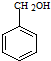
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
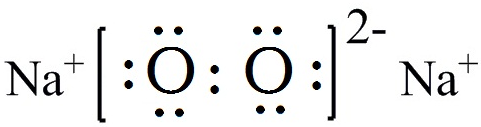 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属导电,属于电解质 | |
| B. | 乙酸是有机物,属于非电解质 | |
| C. | 只有在水溶液中能够导电的物质才属于电解质 | |
| D. | NaCl和Al2O3在熔融状态下均导电,都属于电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com