
向NaOH和Na2CO3混合溶液中滴加0.1molgL﹣1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示.下列判断正确的是()

A. 在0﹣a范围内,只发生中和反应
B. ab段发生反应的离子方程式为:CO32﹣+2H+=CO2↑+H2O
C. a=0.2
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为2:1
考点: 有关混合物反应的计算;钠的重要化合物.
专题: 计算题.
分析: 对NaOH和Na2CO3混合配成的溶液,当滴加盐酸时,氢氧化钠与盐酸优先发生反应:NaOH+HCl=NaCl+H2O,然后再碳酸钠与盐酸的反应生成碳酸氢钠和氯化钠:HCl+Na2CO3=NaHCO3+NaCl,最后碳酸氢钠与盐酸反应才有二氧化碳气体生成,利用物质的量的关系并结合图象即可解答.
解答: 解:A.向NaOH和Na2CO3混合溶液中滴加盐酸时,首先和NaOH反应生成水和氯化钠:NaOH+HCl=NaCl+H2O,继续滴加时,盐酸和Na2CO3开始反应,首先发生反应HCl+Na2CO3=NaHCO3+NaCl,继续滴加时发生反应:NaHCO3+HCl=NaCl+H2O+CO2↑,此时开始放出气体,故A错误;
B.ab段发生反应为:NaHCO3+HCl=NaCl+H2O+CO2↑,反应的离子方程式为:HCO 3﹣+H+=H2O+CO2↑,故B错误;
3﹣+H+=H2O+CO2↑,故B错误;
C.根据碳元素守恒,混合物中,碳酸钠的物质的量是0.01mol,所以两步反应:HCl+Na2CO3=NaHCO3+NaCl,NaHCO3+HCl=NaCl+H2O+CO2↑,分别消耗的盐酸的量是0.01mol,0.1mol•L﹣1稀盐酸的体积分别是0.1L,所以a=0.3,故C错误;
D、原混合溶液中NaOH与Na2CO3的物质的量分别是0.02mol和0.01mol,物质的量之比为2:1,故D正确;
故选D.
点评: 本题考查了混合物反应的计算,题目难度中等,明确碳酸钠与氯化氢反应是分步进行的为解答关键,试题培养了学生分析图象能力及化学计算能力.


科目:高中化学 来源: 题型:
表明金属甲比金属乙活动性强的叙述正确的是()
A. 在氧化还原反应中,甲失的电子比乙多
B. 同价态阳离子,甲比乙氧化性强
C. 将甲和乙用导线相连接,一同放入CuSO4溶液中,乙的表面有红色的铜析出
D. 将甲、乙组成原电池时,甲为正极
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组混合物中,都能用分液漏斗的是( )
|
| A. | 乙酸乙酯和水 酒精和水 苯酚和水 |
|
| B. | 溴乙烷和水 溴苯和水 硝基苯和水 |
|
| C. | 甘油和水 己烷和水 甲酸和水 |
|
| D. | 苯和甲苯 乙醛和水 乙酸和乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值.下列说法正确的是()
A. 25℃时,pH=13的氨水中含有OH﹣的数目为0.1NA
B. 标准状况下,2.24 LNO2 与水反应生成NO3﹣的数目为0.1NA
C. 1 mol Na被完全氧化生成Na2O2,转移电子的数目为NA
D. 4.0 g H2与足量O2完全反应生成水,反应中断裂共价键的总数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
某混合液中含有等物质的量的CuSO4、FeSO4、Fe2(SO4)3.已知如表数据,下列叙述正确的是()
物质(25℃) Cu(OH)2 Fe(OH)2 Fe(OH)3
Ksp 2.2×10﹣20 8.0×10﹣16 4.0×10﹣38
完全沉淀时的pH ≥6.4 ≥9.6 ≥3~4
A. 混合溶液中:c(SO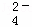 ):=5:4
):=5:4
B. 若向混合溶液中加入铁粉,不可能观察到红色固体析出
C. 若向混合溶液中加入足量氯水,调节pH到3﹣4后过滤,得到纯净的CuSO4溶液
D. 若向混合溶液中逐滴加入烧碱溶液,首先生成Fe(0H)3沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F、X存在如图甲所示转换关系,其中,A是一种正盐,B是气态氢化物,C是单质,F是强酸.X可能是强酸,也可能是强碱.
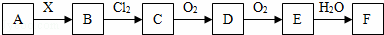
(1)A的化学式是 .
(2)若X是强酸,将D与Cl2同时通入水中发生反应的离子方程式为 .
(3)若X是强碱,过量的B跟Cl2反应除生成C外,另一产物是氯化物.
①过量的B跟Cl2反应的化学方程式为 .
②工业生产中B→D的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
已知分子式为C12H12的物质A的结构简式为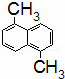 ,其苯环上的二溴代物有9种同分异构体,由此推断A苯环上的四溴代物的同分异构体的数目有()
,其苯环上的二溴代物有9种同分异构体,由此推断A苯环上的四溴代物的同分异构体的数目有()
A. 9种 B. 10种 C. 11种 D. 12种
查看答案和解析>>
科目:高中化学 来源: 题型:
物质的性质决定了物质的用途,下面列出了金属的几种性质:①导热性②导电性③还原性④延展性⑤具有金属光泽。请在下面金属用途后的横线上填上金属性质对应的序号。
(1)用铝锭制成包装用的铝箔________________,
(2)用铝制成的高压铝锅________________,
(3)用铁粉回收照相业废液中的银________________,
(4)电信业中大量使用的铜丝、金属电缆______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com