
ijͬѧ���ʵ��֤��ͭ��Ũ�����ܷ�����Ӧ��������������������ʣ���ͼ��ʾ�����Թ������2mLŨ���ᣬ�ô����ܺ�һ��С�Ľ����������ӿ��в���һ��ͭ˿�����ȣ��ѷų�����������ͨ��Ʒ����Һ��ʯ����Һ�С�
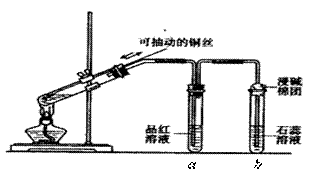
��ش��������⣺
��1��д��ͭ��Ũ���ᷴӦ�Ļ�ѧ����ʽ�� ��
��2���Թ�a��b�ֱ�������������������д���۲쵽�����������á�
�Թ�a�е������� �������� ��
�Թ�b�е������� �������� ��
��3���Թ�b�ܿ���һ�Ž����ռ���Һ�������������� ��
��صķ�Ӧ�ǣ���д���ӷ���ʽ�� ��
��4����ͼ�ÿɳ鶯��ͭ˿���ϻ�ѧʵ�顰��ɫ������ԭ���� ��
��1�� Cu +2H2SO4��Ũ�� CuSO4 + SO2��+2H2O ��3�֣�
CuSO4 + SO2��+2H2O ��3�֣�
��2�� �ų���������ʹƷ����Һ��ɫ����2�֣�֤������������Ư���ԡ���1�֣�
�ų�������ʹ��ɫʯ����Һ��죬��2�֣�֤���������������ԡ���1�֣�
��3�������ݳ���SO2���壬��ֹ��Ⱦ��������1�֣�SO2+ 2OH- = SO32- + H2O ��2�֣�
��4��ͨ������ͭ˿�ĸ߶ȣ����Կ��Ʋμӷ�Ӧ��ͭ��Ũ����ĽӴ������1�֣����Ӷ�����SO2��������������SO2����Ⱦ����1�֣�
������ʽδ��ƽ����������������������Ź���1�֣���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��һ������SO2��O2���ݻ��̶���2L�ܱ������ڷ�����Ӧ��2SO2+O2 2SO3�������(SO2)=0.05 mol/(L·min)����2 min��SO3�����ʵ���Ϊ
2SO3�������(SO2)=0.05 mol/(L·min)����2 min��SO3�����ʵ���Ϊ
A��0.1 mo1/L B��0.2mol/L C��0.1mol D��0.2mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��200 mL 0.1 mol��L��1 FeCl2��Һ�м�������NaOH��ʹFe2��ǡ����ȫ������С�ļ��ȴ˻���ֱ��ˮ�����ɣ�Ȼ�����յ��������ٱ仯����ʱ���������Ϊ(����)��
A��1.6 g B��2.34 g
C��3.94 g D��5.00 g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����ƶ���ȷ����(����)
A��CO2��SO2��SO3��SiO2��NO2���������������NaOH��Һ��Ӧ
B��Na2O��Na2O2���Ԫ����ͬ����CO2��Ӧ����Ҳ��ͬ
C��CO��NO��NO2���Ǵ�����Ⱦ���壬�ڿ����ж����ȶ�����
D��������ˮ�����ԣ������еμ�������ɫʯ����Һ���������Һ�ȱ�����ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����Լ������ô��������IJ���ƿ��ŵ��� (����)
A��NaOH��Һ B������ C��Ũ���� D�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ͺϳɵ��Բ��ϵĽṹ��ʽ���£�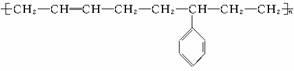 �ϳɴ��ֵ��Բ��ϵĵ����У� ��
�ϳɴ��ֵ��Բ��ϵĵ����У� ��
A.1�� B.2�� C.3�� D.4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�߷��Ӳ��Ͽ����������Ե���ϣ�������Ϊ�� ��
A.�߷��ӵĽṹ�dz���״��
B.�߷��Ӽ�����õķ��Ӽ�����ǿ
C.�߷��ӻ����������ԭ�����Թ��ۼ���ϵ�
D.�߷�����֮�䷢���˲���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���н���������;������ķ�Ӧ����ʽ��ȷ����
A��������������γɻ��漰��Ӧ��2H2SO3+O22H2SO4
B���ȵĴ�����Һ������ϴ���۵�ԭ��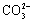 +2H2O
+2H2O H2CO3+2OH?
H2CO3+2OH?
C��ʢ��NaOH��Һ���Լ�ƿ�����ò�������SiO2+2OH?=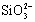 +H2O
+H2O
D���ɷ�Ϊ����Ľ������84����Һ���ʹ�����ж���Cl��+ ClO��+2H+= Cl2��+ H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ʵ�����Ʊ��������ķ����ǽ�����Ũ�����Ũ����Ļ��Һ���ȵ�55��60 �淴Ӧ����֪�����������Ļ��������������±���ʾ��
| �۵� | �е� | ״̬ | |
| �� | 5.51 �� | 80.1 �� | Һ�� |
| ������ | 5.7 �� | 210.9 �� | Һ�� |
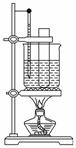 (1)Ҫ����Ũ�����Ũ����Ļ�����ע��������_________
(1)Ҫ����Ũ�����Ũ����Ļ�����ע��������_________
__________________________________________________��
(2)������������ˮ�Ļ����ķ�����____________�������������ͱ��ķ����� _______________________��
(3)ijͬѧ����ͼװ����ȡ��������
����ˮԡ���ȵ��ŵ���_____________________________________________��
��ָ����װ�õ�����ȱ��___________________________________________��
_______________________________________________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com