
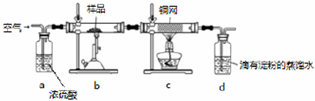
分析 该实验原理是:根据黄铜矿受热分解产生的二氧化硫的量的测定(二氧化硫可以用碘水来标定),结合元素守恒可以确定黄铜矿的量,进而计算其纯度.
(1)CuFeS2,S为-2价元素Cu元素化合价+2价,Fe元素化合价为+2价,反应后铜元素化合价降低,铁元素化合价升高,硫元素化合价升高,氧元素化合价降低,氧化产物是元素化合价升高的被氧化得到氧化产物,依据电子守恒计算电子转移总数;
(2)根据样品称量的精确度来分析;增大固体的表面积可以加快化学反应速浓硫酸可以将水除去,灼热的铜网可以除去多余的氧气;
(3)用标准碘溶液滴定d中溶液的反应是二氧化硫被溴单质氧化生成硫酸和氢溴酸,根据反应结束时的颜色变化判断滴定终点,当达到滴定终点时,二氧化硫已经被碘单质消耗完毕,再滴入一滴碘单质,遇到淀粉会变蓝;
(4)二氧化硫全部被吸收是实验成败的关键;
(5)根据滴定管的读数方法和要求来回答判断,根据反应实质,得到:2I2~2SO2~CuFeS2,结合定量关系计算;
(6)二氧化碳和二氧化硫均可以和氢氧化钡反应生成白色沉淀,亚硫酸钡易被氧化为硫酸钡.
解答 解:该实验原理是:根据黄铜矿受热分解产生的二氧化硫的量的测定(二氧化硫可以用碘水来标定),结合元素守恒可以确定黄铜矿的量,进而计算其纯度.
(1)CuFeS2,S为-2价元素Cu元素化合价+2价,Fe元素化合价为+2价,反应后铜元素化合价降低,铁元素化合价升高,硫元素化合价升高,氧元素化合价降低,氧化产物是元素化合价升高的被氧化得到氧化产物,氧化产物为:Fe3O4、SO2 ,依据电子守恒计算电子转移总数,反应中3Cu2+~3Cu~6e-,8O2~Fe3O4+6SO2
~32e-,生成6molSO2,电子转移总数为38mol,当生成0.3molSO2气体时1.9mol电子,
故答案为:Fe3O4、SO2 ;1.9;
(2)将样品研细后再反应,即增大固体的表面积,目的是使原料充分反应、加快反应速率,灼热的铜网可以除去多余的氧气,
故答案为:增大接触面积,使原料充分反应、加快反应速率;除去多余的氧气;
(3)用标准碘溶液滴定d中溶液的反应是二氧化硫被溴单质氧化生成硫酸和氢溴酸,反应的离子方程式为:SO2+Br2+2H2O=4H++2Br-+SO42-,当达到滴定终点时,二氧化硫已经被碘单质消耗完毕,再滴入一滴碘单质,遇到淀粉会变蓝且半分钟不褪色,证明反应达到反应终点,
故答案为:SO2+Br2+2H2O=4H++2Br-+SO42-,锥形瓶中的溶液由无色变为蓝色且半分钟不褪色;
(4)黄铜矿受热分解生成二氧化硫等一系列产物,分解完毕后仍然通入空气,可以将产生的二氧化硫全部排出去,使结果精确,
故答案为:使反应生成的SO2全部进入d装置中,使结果精确;
(5)根据滴定管的示数是上方小,下方大,可以读出滴定管示数是20.00mL,当达到滴定终点时,二氧化硫已经被碘单质消耗完毕,再滴入一滴碘单质,遇到淀粉会变蓝,根据反应实质,得到:2I2~2SO2~CuFeS2,消耗掉0.05mol/L标准碘溶液20.00mL时,即消耗的碘单质的量为:0.05mol/L×0.02L=0.0010mol,所以黄铜矿的质量是:0.5×0.0010mol×184g/mol×10=0.92g,所以其纯度是:$\frac{0.92g}{1.84g}$×100%=50%,
故答案为:50%;
(6)空气中的CO2与Ba(OH)2反应可以生成BaCO3沉淀,此外BaSO3被氧化成BaSO4均可以导致所以的沉淀的量比二氧化硫和氢氧化钡反应生成的白色沉淀的量多,
故答案为:空气中的CO2与Ba(OH)2反应生成BaCO3沉淀,BaSO3被氧化成BaSO4.
点评 本题考查了探究黄铜矿的纯度,涉及了仪器选择、纯度计算等知识,题量较大,充分考查了学生分析和解决问题的能力,本题难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:解答题
 .
. (写出一种即可).
(写出一种即可).
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它与金刚石互为同素异形体 | |
| B. | 它与C60互称同分异构体 | |
| C. | 它与C60的物理性质与化学性质完全相同 | |
| D. | 它与13C互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 四 | ⑩ | ⑪ | ⑫ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:丙>乙>甲>丁 | |
| B. | 气态氢化物的熔点:丙>甲 | |
| C. | 乙元素在自然界中形成的化合物种类最多 | |
| D. | 乙和甲、丙、丁都一定能形成两种或两种以上的共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | H2、I2和HI分子中的化学键都是非极性共价键 | |
| B. | 断开2mol HI分子中的化学键所需能量约为(c+b+a)kJ | |
| C. | 相同条件下,1mol H2(g)和1mol I2(g)总能量小于2molHI(g)的总能量 | |
| D. | 向密闭容器中加入2mol H2(g)和2mol I2(g),充分反应后放出的热量小于2a kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com