
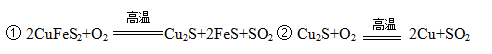



 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源:不详 题型:单选题
| A.向铁粉中加入足量稀硝酸:2Fe+6H+=2Fe3++3H2↑ |
| B.向AlCl3溶液中滴加浓氨水至过量:Al3++4OH-=AlO2-+2H2O |
| C.向NaIO3溶液中加入适量NaHSO3溶液:IO3-+3HSO3-=I-+3SO42-+3H+ |
| D.向NH4HCO3溶液中滴加过量NaOH溶液:NH4++HCO3-+2OH-=CO32-+NH3·H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向氯化铁溶液中滴加HI溶液:2Fe3++2HI=2Fe2++2H++I2 |
| B.向NH4Al(SO4)2溶液中滴入Ba(0H)2恰好使反应完全:2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O |
| C.1mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积均匀混合:2AlO2-+5H+=Al(OH)3↓+Al3++H2O |
| D.用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na2CO3溶液与NaHSO4溶液反应:CO32--+2H+=CO2↑+H2O |
| B.向硫酸铵溶液中加入氢氧化钡溶液:Ba2++SO42-=BaSO4↓ |
| C.碘化钾溶液中滴入稀硫酸酸化的双氧水反应:2I-+H2O2+2H+=H2O+I2 |
| D.海水制取溴时用纯碱吸收吹出的溴:3Br2+3H2O=5Br-+BrO3-+6H+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na2O2是离子化合物,其阴、阳离子个数比为1∶1 |
B.N(NO2)3( )既有氧化性又有还原性 )既有氧化性又有还原性 |
C.NH4HCO3溶液与过量的NaOH溶液微热反应:NH4++OH- NH3↑+H2O NH3↑+H2O |
| D.铜片溶于稀硝酸中:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.碳酸氢钠可作食品膨松剂:2NaHCO3  Na2CO3+ CO2↑+H2O Na2CO3+ CO2↑+H2O |
| B.铝制容器不能盛装碱液:2Al +2OH-+2H2O = 2AlO2-+ 3H2↑ |
| C.氯气可用于消毒:Cl2+H2O = 2H++ Cl-+ClO- |
| D.过氧化钠可用于呼吸面具:2Na2O2 + 2CO2 =" 2" Na2CO3 + O2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施加快反应速率且有利于提高H2O的平衡转化率的是 。(填序号)
CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施加快反应速率且有利于提高H2O的平衡转化率的是 。(填序号)| A.升高温度 | B.增加碳的用量 | C.加入催化剂 | D.用CO吸收剂除去CO E.增大压强 |
 2CO(g) △H=+172.5kJ?mol-1
2CO(g) △H=+172.5kJ?mol-1 CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:| 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所x需时间/min | ||
| H2O | CO | H2 | CO | ||
| 900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
 2NH3(g) ΔH=-92.4kJ?mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。
2NH3(g) ΔH=-92.4kJ?mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。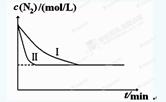

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


| ①所有的离子方程式均可以表示一类反应 | |
| ②酸碱中和反应均可表示为H++OH-=H2O | |
| ③离子方程式中凡是难溶性酸、碱、盐均要标“↓”符号 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com