
常温下,下列各组离子能大量共存的是
A. pH=12的溶液中:K+、Na+、Br-、AlO2-
B. 无色溶液中:H+、K+、MnO4-、C2O42-
C. c(Fe3+) = 0.1 mol·L-1的溶液中:K+、H+、SCN-、I-
D. 由水电离出的c(OH-) =1.0×10-13 mol·L-1的溶液中:Na+、NH4+、SO42-、HCO3-
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:
在下图转化关系中,已知B、D都是淡黄色固体,请回答下列问题。
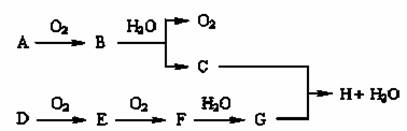
⑴写出下列物质的化学式:B ,G 。
⑵写出下列反应的化学方程式:
A→B: ;E→F: ;B→C: 。
⑶将过量气体E通入到下列各组溶液后,离子仍能大量共存的是 。
A.Ba2+、Ca2+、Cl- B.OH-、CO32-、Na+
C.Ca2+、ClO-、Cl- D.H+、Fe3+、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
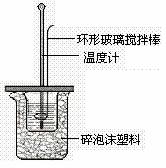 已知测定中和热的实验步骤如下:①量取30mL 0.5 mol/L硫酸倒入小烧杯中,测量温度; ②量取50mL 0.5mol/L NaOH溶液,测量温度; ③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。回答下列问题
已知测定中和热的实验步骤如下:①量取30mL 0.5 mol/L硫酸倒入小烧杯中,测量温度; ②量取50mL 0.5mol/L NaOH溶液,测量温度; ③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。回答下列问题
(1)硫酸溶液稍过量的原因 。
(2)需要测定 个数据,加入NaOH溶液的正确操作是
,使硫酸与氢氧化钠溶液混合均匀的正确操作是 。
(3)设溶液的密度均为1g·cm-3,中和后溶液的比热容c=4.18J·(g·℃)-1,实验前后温度差平均值是△t,请根据实验数据求出中和热为 ,写出该反应的热化学方程式_________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的工业制备原理的方程式书写正确的是
A.乙醇:C6H12O6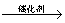 2CH3CH2OH + 2CO2↑
2CH3CH2OH + 2CO2↑
|
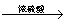 CH2=CH2↑+ H2O
CH2=CH2↑+ H2O C.盐酸:NaCl + H2SO4 NaHSO4 + HCl↑
NaHSO4 + HCl↑
D.纯碱:2NaCl + 2NH3 + CO2 + H2O → Na2CO3↓+ 2NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关工业生产的叙述正确的是
A.合成氨生产过程中升高温度可加快反应速率,缩短生产周期,故温度越高越好
B.硫酸工业中,使用催化剂是为了提高SO2转化为SO3的转化率
C.电解精炼铜时,精铜作阴极
D.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学设计了两种方案制备氢氧化铝。
方案一:2.7 g Al X溶液
X溶液 Al(OH)3沉淀
Al(OH)3沉淀
方案二:2.7 g Al Y溶液
Y溶液 Al(OH)3沉淀
Al(OH)3沉淀
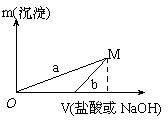 已知所用的稀盐酸与NaOH溶液均为3mol/L。右图是向
已知所用的稀盐酸与NaOH溶液均为3mol/L。右图是向
X溶液与Y溶液中分别加入NaOH溶液或稀盐酸时产生
沉淀的质量与加入溶液体积之间的关系。相关说法正确的是
A.a曲线表示的是向X溶液中加入NaOH溶液
B.在M点时,两种方案中所得溶液的溶质质量分数相同
C.方案二比方案一生成更多的气体
D.M点以后,a、b两条曲线将重合为一条
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实不能用勒夏特列原理解释的是
A. FeS不溶于水,但能溶于稀盐酸中 B.钢铁在潮湿的空气中容易生锈
C.实验室中常用排饱和食盐水的方式收集氯气
D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)基态Si原子中,电子占据的最高能层符号为 ,该能层具有的原子轨道数为 、电子数为 。
(2)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:

①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是 。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com