
����Ŀ���ܣ�Co�����仯�����ڹ�ҵ���й㷺Ӧ�ã�Ϊ��ij��ҵ�����л����ܣ�ijѧ������������£������к���Al��Li��Co2O3��Fe2O3�����ʣ���
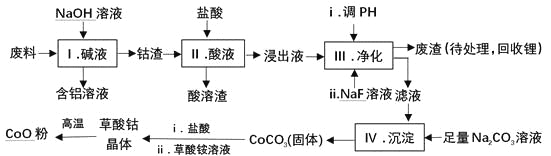
��֪���������ܽ��ԣ�LiF������ˮ��CoCO3������ˮ��
�����ֽ��������γ��������������pH���±���
Fe3+ | Co2+ | Co3+ | Al3+ | |
pH����ʼ������ | 1.9 | 7.15 | ��0.23 | 3.4 |
pH����ȫ������ | 3.2 | 9.15 | 1.09 | 4.7 |
��ش�
��1�����еõ�������Һ�ķ�Ӧ�����ӷ���ʽ�� ��
��2�����еõ�������ʵ������� ����������ƣ���
��3��д����������Co2O3�����ᷴӦ����Cl2�����ӷ���ʽ�� ��
��4���������е�����Һ��pHʱ�� pH�ķ�Χ�� ��
��5�������е���Ҫ�ɷ��� ��
��6���ڿ����м���10.98g�����ܾ��壨CoC2O42H2O����Ʒ�����ȹ����в�ͬ�¶ȷ�Χ�ڷֱ�õ�һ�ֹ������ʣ������������
�¶ȷ�Χ/�� | ��������/g |
150��210 | 8.82 |
290��320 | 4.82 |
890��920 | 4.5 |
�����ȵ�210��ʱ���������ʵĻ�ѧʽΪ�� ��
�����ⶨ�����ȵ�210��310�������е�������ֻ��CO2���ܵ�������˹��̷�����Ӧ�Ļ�ѧ����ʽΪ�� ����
���𰸡���1��2Al+2OH��+2H2O=2AlO2��+3H2������2�����ˣ�
��3��Co2O3+6H++2Cl��=2Co2++Cl2��+3H2O��
��4��3.2��PH<7.15����5��Fe��OH��3��LiF��
��6����CoC2O4����3CoC2O4+2O2===Co3O4+6CO2��
�������������������1��Al������������Һ��Ӧ�������ӷ�Ӧ����ʽΪ��2Al��2OH����2G2O=2AlO2����3H2������2���õ���Һ����������˲��ò��������ǹ��ˣ���3��Co2O3�������������ϼ��ɣ�3������2�ۣ����ϼ۹�����2�ۣ�HCl��Cl�ɣ�1����0�ۣ����ϼ�����1�ۣ���С������Ϊ2��������ӷ�Ӧ����ʽΪCo2O3��2Cl����6H��=2Co2����3H2O��Cl2������4����Һ�к�������������Li����Fe3������������ͼ��Fe3��ת����Fe��OH��3����Co2������ת���ɳ�������pH�ķ�ΧΪ3.2��pH<7.15����5��������ϢLiF������ˮ����˵õ�������Fe��OH��3��LiF����6����CoC2O4��2H2Oʧȥȫ���ᾧˮ������Ϊ��10.98��147/183g=8.82g�������ȵ�210��ʱ������������CoC2O4��������Ԫ���غ㣬n��CO2��=8.82��2/147mol=0.12mol������Ϊ0.12��44g=5.28g�����������٣�8.82��4.82��g=4g��˵��������μӷ�Ӧ���������μӣ�����������Ϊ��5.28��4��g=1.28g�������ʵ���Ϊ1.28/32mol=0.04mol��n��COC2O4��:n��O2��=n��CO2��=8.82/147��0.04��0.12=0.06��0.08��0.12=3��2��6������ԭ���غ㣬3CoC2O4+2O2===Co3O4+6CO2��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʲ������л�����ǣ� ��
A. ���� B. �軯��(NaCN) C. ����(C17H33COOH) D. ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��µĺ����ܱ������У���������Щ�����ٷ����仯ʱ������������Ӧ��
A��s����2B��g��![]() C��g����D��g���Ѵﵽƽ��״̬��
C��g����D��g���Ѵﵽƽ��״̬��
�ٻ�������ѹǿ �ڻ��������ܶ�
��B�����ʵ���Ũ�Ȣ�����������ʵ���
�ݻ�������ƽ����Է�������
������C�İٷֺ��� �߸���������ʵ���
�൱��1molB������Ӷϼ���ͬʱ��1/2molC������Ӷϼ�
A���ڢۢݢޢߢ� B���٢ڢۢޢߢ� C���ڢۢܢݢޢ� D���٢ۢܢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ҫ�ɷ�Ϊ���������������Ͷ������裬��ҵ�Ͼ������й��տ���ұ����������
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
����˵���д������( )
A���٢��г����Լ��⣬����Ҫ���й��˲���
B��a��b����Ԫ�صĻ��ϼ���ͬ
C��������Ҫͨ������İ���
D�������еIJ����Ǽ��ȣ�����dһ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)����ĵ�һ�������������У����õ�ȼ��Ϊƫ�����º�������������ƫ�����¿��������Ʊ���
������(N2H4)��ȼ�ϣ������������������������߷�Ӧ���ɵ�������̬ˮ��
��֪�� N2(g)��2O2(g)===N2O4(g) ��H����10.7 kJ��mol��1
N2H4(g)��O2(g)===N2(g)��2H2O(g) ��H����543 kJ��mol��1
д����̬�º�N2O4��Ӧ���ɵ�������̬ˮ���Ȼ�ѧ����ʽ��________________________��
����֪�����������ڴ����л��ڽϸ��¶��º����ȶ����ڣ���������ת��Ϊ�������������ƶϳ�����������ȡ�����������ķ�Ӧ����(���ʩ)�� ____________________��
(2)��0.5L�����ܱ������У�һ������N2��H2���з�Ӧ��N2(g)+3H2(g)![]() 2NH3(g) ��H=bkJmol��1���仯ѧƽ�ⳣ��Kֵ���¶ȵĹ�ϵ���£�
2NH3(g) ��H=bkJmol��1���仯ѧƽ�ⳣ��Kֵ���¶ȵĹ�ϵ���£�
�¶�/�� | 200 | 300 | 400 |
K | 1.0 | 0.86 | 0.5 |
д���÷�Ӧ�Ļ�ѧƽ�ⳣ���ı���ʽ�� ��b 0(����ڡ�����С�ڡ����ڡ�)
��400��ʱ�����ijʱ�̰��������������������ʵ����ֱ�Ϊ3mol��2mol��1molʱ����ʱ�̸÷�Ӧ��v��(N2) v��(N2)(����ڡ�����С�ڡ����ڡ�)
(3)��ѧ�������һ��ʹ�ù������ʵ�ȼ�ϵ�أ���Ч�ʸ��ߣ������ں��պ��졣��ͼ1��ʾװ���У���ϡ���������������Ե缫���������Ϸֱ�ͨ��CH4�Ϳ��������й��������Dz�����Y2O3��ZrO2���壬���ڸ������ܴ����������ɵ�O2������(O2��4e��===2O2��)��

��c�缫������Ϊ________��d�缫�ϵĵ缫��ӦʽΪ______________________��
����ͼ2��ʾΪ�ö��Ե缫���100 mL 0.5 mol��L��1CuSO4��Һ��a�缫�ϵĵ缫��ӦʽΪ___________________����a�缫����56 mL(��״��)���壬��������Һ��pH��__________(��������Һ����仯) ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ����ʱ�ܵ��������һ�������ӻ�����
B. NaOH��H2SO4����ˮ���˷������Ӽ�
C. CO2��NCl3������ԭ������㶼����8���ӽṹ
D. ���ʯ������ϩ��ͬ�������壬�ۻ�ֻ�˷����ۼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ��������������ۣ�NaHCO3����������
B. ���õ�ⱥ��ʳ��ˮ����ȡ������
C. �ƿɴ�TiCl4��Һ���û���Ti
D. ����ȼ�ϵ�ع���ʱʵ���˵���ת��Ϊ��ѧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A��Ħ���ǹ��ʿ�ѧ�罨����õ�һ��������
B��HNO3��Ħ��������63g
C�����ǰѺ���6.02��1023�����ӵ��κ����ӵļ������Ϊ1Ħ��
D��1mol����6.02��1023��O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȥCO2�л��е�����SO2���壬����ѡ�õ��Լ��ǣ� ��
A.KMnO4��Һ
B.NaClO��Һ
C.����NaHCO3��Һ
D.����Na2CO3��Һ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com