
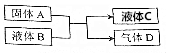
 中学化学中有很多物质可以实现如图中物质之间的转化,其中反应条件和部分反应的产物已略去,液体B和C可能是单一溶质的溶液,也可能是纯净物.
中学化学中有很多物质可以实现如图中物质之间的转化,其中反应条件和部分反应的产物已略去,液体B和C可能是单一溶质的溶液,也可能是纯净物.分析 (1)液体C加入KSCN溶液无明显现象,再加入氯水立即变为血红色,应含有Fe2+,则A为Fe,B为盐酸或硫酸,D为H2;
(2)A是紫红色金属单质,D是一种无色气体,遇到空气变为红棕色,液体C呈蓝色,可知A为Cu,D为NO,则B为HNO3,C为Cu(NO3)2;
(3)A是黑色固体单质,D是两种气体的混合物,其中有一种气体能使品红溶液褪色,加热时又恢复原色,另一气体能使澄清石灰水变浑浊,应为碳和浓硫酸的反应,生成二氧化碳、二氧化硫和水;
(4)A是能溶于水的白色固体粉末,气体D能使澄清石灰水变浑浊,D为二氧化碳,A为碳酸氢钠.
解答 解:(1)液体C加入KSCN溶液无明显现象,再加入氯水立即变为血红色,应含有Fe2+,则A为Fe,B为盐酸或硫酸,D为H2,反应的化学方程式可能为Fe+2HCl=FeCl2+H2↑,故答案为:Fe+2HCl=FeCl2+H2↑;
(2)A是紫红色金属单质,D是一种无色气体,遇到空气变为红棕色,液体C呈蓝色,可知A为Cu,D为NO,则B为HNO3,C为Cu(NO3)2,A与B溶液反应的离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,二氧化氮和水反应的化学方程式为3NO2+H2O=2HNO3+NO,
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;3NO2+H2O=2HNO3+NO;
(3)A是黑色固体单质,D是两种气体的混合物,其中有一种气体能使品红溶液褪色,加热时又恢复原色,另一气体能使澄清石灰水变浑浊,应为碳和浓硫酸的反应,生成二氧化碳、二氧化硫和水,反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O;
(4)A是能溶于水的白色固体粉末,气体D能使澄清石灰水变浑浊,D为二氧化碳,A为碳酸氢钠,为碳酸氢钠和酸的反应,离子方程式为H++HCO3-=CO2↑+H2O,故答案为:H++HCO3-=CO2↑+H2O.
点评 本题考查无机物的推断,为高频考点,题目难度不大,本题注意把握物质的特征性质,为解答推断题的突破口,注意把握相关物质的性质,为解答该题的关键.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ①②③④ | C. | ①③④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
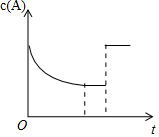 一定温度下,将一定量的A、B气体充入密闭容器,发生反应:A(g)+B(g)?xC(g)+3D(?),反应平衡后,改变影响平衡的一个条件,物质A的浓度变化如图所示.下列有关说法正确的是( )
一定温度下,将一定量的A、B气体充入密闭容器,发生反应:A(g)+B(g)?xC(g)+3D(?),反应平衡后,改变影响平衡的一个条件,物质A的浓度变化如图所示.下列有关说法正确的是( )| A. | x=2,C为气态,D可能为气态也可能为非气态 | |
| B. | 改变的条件可能是使用了催化剂 | |
| C. | 其他条件不变,若向容器中再加入少量C,平衡逆向移动但平衡常数不变 | |
| D. | 该反应的化学平衡常数K=$\frac{{c}^{2}(C)}{[c(A)•c(B)]}$,且温度升高,K值增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、NO3-、MnO4- | B. | K+、Na+、Cl-、SO42- | ||
| C. | K+、Na+、Cl-、Cu2+ | D. | Na+、Ba2+、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 室温时向100mL,0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到溶液PH与NaOH溶液体积的关系曲线如图B所示:
室温时向100mL,0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到溶液PH与NaOH溶液体积的关系曲线如图B所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图为Na2SO4的溶解度曲线,已知硫酸钠晶体(Na2SO4•10H2O)在温度为
如图为Na2SO4的溶解度曲线,已知硫酸钠晶体(Na2SO4•10H2O)在温度为| A. | 32.8g | B. | 40g | C. | 40.8g | D. | 41g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入催化剂,反应的△H变大 | B. | 升高温度,混合气体的密度增大 | ||
| C. | 压缩容器,反应吸收的热量不变 | D. | 分离出部分MgO,可增大CO的转化率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com