
分析 (1)从N原子守恒的角度计算硝酸铜的物质的量;
(2)从氧化还原反应得失电子守恒的角度计算;
(3)根据质量和电子守恒列方程式计算X的取值范围.
解答 解:(1)根据N原子守恒可知:n[Cu(NO3)2]=$\frac{0.1L×0.6mol/L-\frac{0.224L}{22.4L/mol}}{2}$=0.025mol,
答:产物中硝酸铜的物质的量为0.025mol;
(2)由Cu元素守恒可得:2×n(Cu20)+n(CuO)+0.01mol=0.025mol,
由氧化还原反应得失电子守恒可知:0.01×2+2×n(Cu20)=$\frac{0.224L}{22.4L/mol}$×3,
解得:n(Cu20)=0.005mol,n(CuO)=0.005mol,
答:如混合物中含0.0lmoLCu,则其中Cu20、CuO的物质的量均为0.005mol;
(3)由Cu元素守恒可得:2×n(Cu20)+n(CuO)+X=0.025mol,
由氧化还原反应得失电子守恒可知:X×2+2×n(Cu20)=0.01×2+2×n(Cu20)=$\frac{0.224L}{22.4L/mol}$×3,
解得:n(CuO)=X-0.005mol、n(Cu20)=0.015mol-X,
则X的范围为:0.005mol<X<0.015mol,
答:如混合物中Cu的物质的量为X,X的取值范围为0.005mol<X<0.015mol.
点评 本题考查混合物反应的计算,题目难度中等,注意从质量守恒和氧化还原反应得失电子守恒的角度分析,试题培养了学生的分析能力及化学计算能力.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:选择题
| A. | 提倡骑自行车或乘公交车上下班 | B. | 提倡使用一次性木筷 | ||
| C. | 推广使用无磷洗衣粉和无氟冰箱 | D. | 将煤液化或气化,获得清洁燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;该元素还可与元素①形成10电子的气体分子Y,将过量的Y气体通入盛有含⑩元素的硫酸盐溶液中,反应过程中的实验现象为:先产生蓝色沉淀,后沉消失,变成深蓝色的溶液;反应过程中的离子方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-
;该元素还可与元素①形成10电子的气体分子Y,将过量的Y气体通入盛有含⑩元素的硫酸盐溶液中,反应过程中的实验现象为:先产生蓝色沉淀,后沉消失,变成深蓝色的溶液;反应过程中的离子方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH- 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
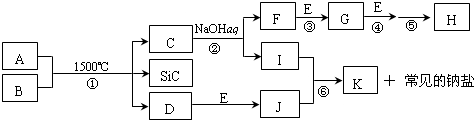
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
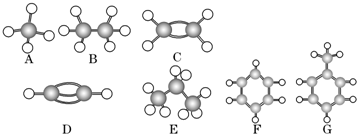
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 物质 | 试剂 | 分离方法 |
| ① | 乙酸乙酯(乙酸) | NaOH溶液 | 分液 |
| ② | 溴苯(溴) | NaOH溶液 | 分液 |
| ③ | 乙醇(水) | 生石灰 | 蒸馏 |
| ④ | 苯(环己烷) | 水 | 分液 |
| A. | ①② | B. | ①③ | C. | ②③ | D. | ④③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.| 编号 | 性质 | 化学方程式 |
| 示例 | 氧化性 | H2WO3+3H3PO3═3H3PO4+H2W↑ |
| 1 | ||
| 2 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COO-、H+、Na+、K+ | B. | NH4+、OH-、Ba2+、Cl- | ||
| C. | Ca2+、NO3-、Ba2+、K+ | D. | NO3-、Ba2+、H+、Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
| 取一定量样品充分干燥,然后将样品加热分解,将产生的气体依次通过盛有无水硫酸铜的干燥管和盛有澄清石灰水的烧瓶 | 若无水硫酸铜不变蓝色,澄清石灰水变浑浊,说明样品全部是PbCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com