
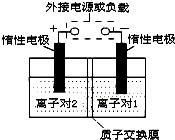
 全钒液流储能电池,是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置.现将钒的相关化合物溶解在pH=1的稀硫酸中,按下图组装一个模拟电池.
全钒液流储能电池,是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置.现将钒的相关化合物溶解在pH=1的稀硫酸中,按下图组装一个模拟电池.

 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
| A、用水鉴别乙醇、甲苯和溴苯 |
| B、用燃烧法鉴别乙醇、苯和四氯化碳 |
| C、用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯 |
| D、纤维素在人体内可水解为葡萄糖,故可作人类的营养物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
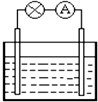
| A、铜为正极 |
| B、锌片上发生氧化反应 |
| C、它是一种把化学能转变为电能的装置 |
| D、电子从铜片流出沿导线流入锌片 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合物中一定不含有Na2O |
| B、混合物中一定不含有Na2CO3和NaCl |
| C、混合物中肯定含Na2O2、Na2O2和NaHCO3 |
| D、混合物中一定不含有Na2O2和NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2NO2?N2O4△H=-57kJ/mol(反应热) | ||
B、
| ||
| C、S(s)+O2(g)═SO2(g)△H=+269.8kJ/mol(反应热) | ||
D、C8H18(l)+
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(NH4+)>c(Cl-),c(OH-)>c(H+) |
| B、c(NH4+)=c(Cl-),c(OH-)=c(H+) |
| C、c(Cl-)>c(NH4+),c(OH-)>c(H+) |
| D、c(Cl-)>c(NH4+),c(H+)>c(NH4+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com