
【题目】镍及其化合物用途广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、
CaO、SiO2等,以下是从该矿渣中回收NiSO4的工艺路线:
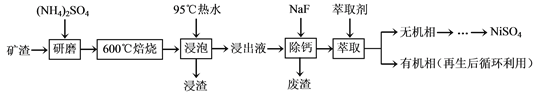
已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。NiFe2O4在焙烧过程中生成
NiSO4、Fe2(SO4)3。
锡(Sn)位于第五周期第ⅣA族。
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是___________________。
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为____________________。
“浸渣”的成分除Fe2O3、FeO(OH)外还含有________(填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将Fe3+还原为Fe2+,所需SnCl2的物质的量不少于Fe3+物质的量的_______倍;除去过量的SnCl2后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,滴定时反应的离子方程式为___________________。
(4)“浸出液”中c(Ca2+) = 1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-) = ________mol·L-1。[已知Ksp (CaF2)=4.0×10-11]
(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如下图所示,V0/VA的最佳取值是______。

【答案】 增大接触面积,加快反应速率,使反应更充分 Fe3++2H2O![]() FeO(OH)↓+3H+ SiO2、CaSO4 0.5 Cr2O72-+6Fe2++14H+
FeO(OH)↓+3H+ SiO2、CaSO4 0.5 Cr2O72-+6Fe2++14H+![]() 2Cr3++6Fe3++7H2O 2.0×10-3 0.25
2Cr3++6Fe3++7H2O 2.0×10-3 0.25
【解析】(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是增大接触面积,加快反应速率,使反应更充分;(2))“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为 Fe3++2H2O![]() FeO(OH)↓+3H+,浸渣”的成分除Fe2O3、FeO(OH)外还含有 SiO2、CaSO4;(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将Fe3+还原为Fe2+,反应为:2Fe3++Sn2+=Sn4++2Fe2+,所需SnCl2的物质的量不少于Fe3+物质的量的一半,为0.5倍;用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,滴定时反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;(4)浸出液”中c(Ca2+) = 1.0×10-3mol·L-1,当除钙率达到99%时,剩余钙离子1%×1.0×10-3molL-1=1×10-5mol/L,溶液中c2(F-) =Ksp/c(Ca2+)=4.0×1011/1×105,所以c2(F-) =2×10-3mol/L;(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,最佳取值是亚铁离子能被萃取,镍离子不被萃取,V0/VA的最佳取值是0.25。
FeO(OH)↓+3H+,浸渣”的成分除Fe2O3、FeO(OH)外还含有 SiO2、CaSO4;(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将Fe3+还原为Fe2+,反应为:2Fe3++Sn2+=Sn4++2Fe2+,所需SnCl2的物质的量不少于Fe3+物质的量的一半,为0.5倍;用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,滴定时反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;(4)浸出液”中c(Ca2+) = 1.0×10-3mol·L-1,当除钙率达到99%时,剩余钙离子1%×1.0×10-3molL-1=1×10-5mol/L,溶液中c2(F-) =Ksp/c(Ca2+)=4.0×1011/1×105,所以c2(F-) =2×10-3mol/L;(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,最佳取值是亚铁离子能被萃取,镍离子不被萃取,V0/VA的最佳取值是0.25。


科目:高中化学 来源: 题型:
【题目】为探究外界条件对可逆反应A(g)+B(g)![]() C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10L的密闭容器中充入1mol A和1molB,反应达平衡时测得容器中各物质的浓度为I。然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为II、III、IV。
C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10L的密闭容器中充入1mol A和1molB,反应达平衡时测得容器中各物质的浓度为I。然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为II、III、IV。
A | B | C | |
I | 0.050mol·L-1 | 0.050mol·L-1 | 0.050mol·L-1 |
II | 0.070mol·L-1 | 0.070mol·L-1 | 0.098mol·L-1 |
III | 0.060mol·L-1 | 0.060mol·L-1 | 0.040mol·L-1 |
IV | 0.080mol·L-1 | 0.080mol·L-1 | 0.12mol·L-1 |
针对上述系列实验,下列结论中错误的是
A. 由I中数据可计算出该温度下反应的平衡常数K=20
B. II可能是通过增大C的浓度实现的
C. 若III只是升高温度,则与I比较,可以判断出正反应一定是放热反应
D. 第IV组实验数据的得出,通过压缩容器的体积就可以实现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属的说法正确的是( )
A. Na久置于空气中最终生成NaHCO3
B. Mg比Al活泼,更易与NaOH溶液反应生成H2
C. 水蒸气通过灼热的铁粉有红棕色固体生成
D. 多数合金比各成分金属熔点低,硬度大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某常见气体在标准状况下的密度为1.25 g·L-1。则该气体的相对分子质量为________。若该气体为化合物,其名称为_____________。
(2)在同温同压下,相等质量的氧气和臭氧,它们的物质的量之比为________,原子个数比为________。
(3)112 mL某气体在标准状况下的质量为0.32 g,该气体的摩尔质量约为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中正确的是
A.某温度时的混合溶液中c(H+)=![]() mol·L-1,说明该溶液呈中性(Kw为该温度时水的离子积常数)
mol·L-1,说明该溶液呈中性(Kw为该温度时水的离子积常数)
B.由水电离出的c(H+)=10-12mol·L-1的溶液中:Na+、Ba2+、HCO3-、Cl-可以大量共存
C.已知Ksp(AgCl)=1.56×10-10, Ksp(Ag2CrO4)=9.0×10-12。向含有Cl-、CrO42-且浓度均为0.010 mol·L-1溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,CrO42-先产生沉淀
D.常温下pH=7的CH3COOH和NaOH混合溶液中,c(Na+)>c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以黄铁矿为原料制硫酸会产生大量的废渣,合理利用废渣可以减少环境污染,变废为宝。工业上利用废渣(含Fe2+、Fe3+的硫酸盐及少量CaO和MgO)制备高档颜料铁红(Fe2O3)和回收(NH4)2SO4,具体生产流程如下:

(1)在废渣溶解操作时,应选用________溶解(填字母)。
A.氨水 B.氢氧化钠溶液 C.盐酸 D.硫酸
(2) 为了提高废渣的浸取率,可采用的措施有哪些?_______________(至少写出两点)。

(3)物质A是一种氧化剂,工业上最好选用________(供选择使用的有:空气、Cl2、MnO2),其理由是_______________。氧化过程中发生反应的离子方程式为_________________。
(4)根据如图有关数据,你认为工业上氧化操作时应控制的条件(从温度、pH和氧化时间三方面说明)是:______________________________________________________。
(5) 铵黄铁矾中可能混有的杂质有Fe(OH)3、________。
(6) 铵黄铁矾的化学式可表示为(NH4)xFey(SO4)z(OH)w,其化学式可通过下列实验测定:
① 称取一定质量的样品加入稀硝酸充分溶解,将所得溶液转移至容量瓶并配制成100.00 mL溶液A。
② 量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体9.32 g。
③ 量取25.00 mL溶液A,加入足量NaOH溶液,加热,收集到标准状况下气体448mL,同时有红褐色沉淀生成。
④ 将步骤③所得沉淀过滤、洗涤、灼烧,最终得固体4.80 g。
通过计算,可确定铵黄铁矾的化学式为___________________________。(已知铵黄铁矾的摩尔质量为960gmol-1,计算过程中不考虑固体损失和气体溶解。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境监察局常用“定电位”NOx传感器来监测化工厂的氮氧化物气体是否达到排放标准,其工作原理如图所示。下列说法不正确的是( )

A. “对电极”是负极
B. “工作电极”上发生的电极反应为NO2+2e-+2H+═NO+H2O
C. 传感器工作时H+由工作电极移向对电极
D. 对电极的材料可能为活泼金属锌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以二氧化碳和氢气为原料制取乙醇的反应为:2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g) ΔH<0。某压强下的密闭容器中,按CO2和H2的物质的量比为1︰3投料,不同温度下平衡体系中各物质的物质的量百分数(y%)随温度变化如图所示。下列说法正确的是( )
CH3CH2OH(g)+3H2O(g) ΔH<0。某压强下的密闭容器中,按CO2和H2的物质的量比为1︰3投料,不同温度下平衡体系中各物质的物质的量百分数(y%)随温度变化如图所示。下列说法正确的是( )

A. a点的平衡常数小于b点
B. b点,υ正(CO2)=υ逆(H2O)
C. a点,H2和H2O物质的量相等
D. 其他条件恒定,充入更多H2,乙醇的物质的量分数增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com