

| A.a点表示的溶液中由水电离出的H+浓度为1.0×10-11 mol·L-1 |
| B.b点表示的溶液c(CH3COO-) > c(Na+) |
| C.c点表示CH3COOH和NaOH恰好反应完全 |
D.b、d点表示的溶液中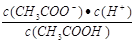 相等 相等 |
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25 ℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A. HX>HY>HZ | B.HY>HX>HZ |
| C. HZ>HY>HX | D.HZ>HX>HY |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H++ RO42-回答下列问题:(1)NaHRO4溶液显 (填“酸性”、“中性”或“碱性”),理由是_________
H++ RO42-回答下列问题:(1)NaHRO4溶液显 (填“酸性”、“中性”或“碱性”),理由是_________查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.c(Na+)=2c(CO32-) |
| B.c(CO32-)>c(OH-)>c(HCO3-)>c(H2CO3) |
| C.c(CO32-)+c(HCO3-)=0.1 mol/L |
| D.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.分别将Na2SO3、Fe2(SO4)3、Ca(HCO3)2、CuCl2溶液蒸干,都不能析出原溶质的晶体 |
| B.草木灰(K2CO3)与铵态氮肥混合施用,会降低氮肥的肥效 |
C.NaHCO3水解的离子方程式为HCO3-+H2O CO32-+H3O+ CO32-+H3O+ |
| D.配制FeCl2溶液时,加入盐酸是防止Fe2+被氧化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.CN-+H2O HCN+OH- HCN+OH- | B.NH3·H2O NH4++OH- NH4++OH- |
C.HCO3-+H2O H3O++CO32- H3O++CO32- | D.H2CO3 HCO3-+H+ HCO3-+H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com