
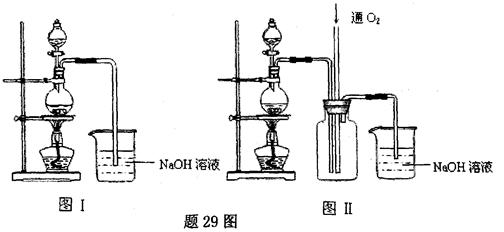
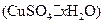 晶体中结晶水的含量时.测得有关数据如下表:
晶体中结晶水的含量时.测得有关数据如下表:| 加热前质量 | 加热后质量 | |
| m1(容器) | m2(容器+晶体) | m3(容器+无水CuSO4) |
| 5.4g | 7.9g | 6.8g |
 中结晶水含量的实验中,称量操作至少进行 次。
中结晶水含量的实验中,称量操作至少进行 次。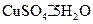 相比
相比 ) (填“偏高”、“偏低”、“不变”),可能的原因是 。(填字母序号)
) (填“偏高”、“偏低”、“不变”),可能的原因是 。(填字母序号) 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:实验题
 管及尾气处理部分不必画出,需要加热的仪器下方用△标出),按气流方向在每件仪器下方标出字母B、C……;其他可选用的仪器(数量不限)简易表示如下:
管及尾气处理部分不必画出,需要加热的仪器下方用△标出),按气流方向在每件仪器下方标出字母B、C……;其他可选用的仪器(数量不限)简易表示如下:
| 仪器符号 | 仪器中所加物质 | 作用 |
| A | 石灰石、稀盐酸 | 石灰石与盐酸生成CO2 |
| | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
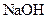 滴定(酚酞做指示剂)。终点时消耗
滴定(酚酞做指示剂)。终点时消耗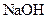 溶液的体积为40.0mL;
溶液的体积为40.0mL;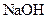 溶液混合均匀后,装上冷凝管,在水浴上加热回流约1小时,装置如图所示。待冷却后,用0.50mol/L
溶液混合均匀后,装上冷凝管,在水浴上加热回流约1小时,装置如图所示。待冷却后,用0.50mol/L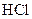 滴定过量的
滴定过量的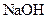 。终点时消耗盐酸的体积为20.0ml。回答:
。终点时消耗盐酸的体积为20.0ml。回答: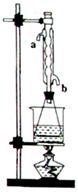
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

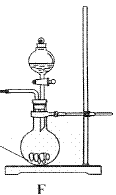
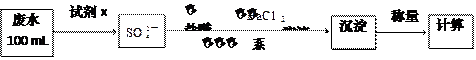
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
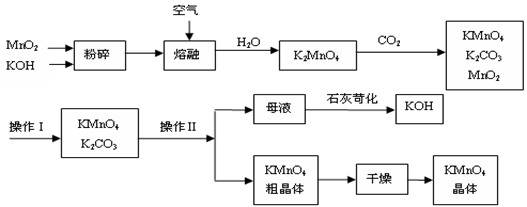
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
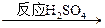 CuSO4。②由Cu
CuSO4。②由Cu CuSO4,试回答:
CuSO4,试回答:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用激光笔检验某KI溶液中是否溶有淀粉 |
| B.加入适量溴水后过滤,可除去苯中的少量苯酚 |
| C.向碘水中加入苯或酒精,均可从碘水中萃取碘 |
| D.向AgCl沉淀中滴加少量KI溶液,可说明Ksp(AgCl)<Ksp (AgI) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.证明一瓶红棕色气体是溴蒸气还是二氧化氮,可用湿润的碘化钾-淀粉试纸检验,观察试纸颜色的变化 |
| B.某溶液中加入碳酸钠溶液产生白色沉淀,再加盐酸沉淀消失,说明该溶液中有Ca2+ |
| C.测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较 |
| D.用核磁共振氢谱图鉴别乙醇和乙酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.根据元素分析结果推测该粉末为纯净物 |
| B.将粉末溶于水,加入氯化钡,观察到有白色沉淀生成,证明原粉末是硫酸钾 |
| C.将粉末加入盐酸中,产生气泡,证明原粉末是亚硫酸钾 |
| D.将粉末溶于水,加入氯化钡和盐酸,观察到有白色沉淀和气泡生成,原粉末可能是硫酸钾和亚硫酸钾的混合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com