
| A. | NaNO2是氧化剂 | |
| B. | NH4Cl中的氮元素被氧化 | |
| C. | 每生成1 mol N2转移的电子的物质的量为6 mol | |
| D. | N2既是氧化剂,又是还原剂 |
分析 由NaNO2+NH4Cl═NaCl+N2↑+2H2O可知,NaNO2中N元素的化合价由+3价降低为0,NH4Cl中N元素的化合价由-3价升高为0,以此来解答.
解答 解:A.NaNO2中N元素的化合价,则为氧化剂,故A正确;
B.NH4Cl中的氮元素化合价升高,失去电子被氧化,故B正确;
C.每生成1 mol N2转移的电子的物质的量为3 mol,故C错误;
D.由反应可知,NaNO2是氧化剂,NH4Cl为还原剂,N2既是氧化产物,又是还原产物,故D错误;
故选CD.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意基本概念的分析,题目难度不大.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:解答题
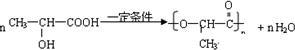
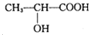 是人体生理活动的一种代谢产物.以下是采用化学方法对乳酸进行加工处理的过程,其中A、H、G为链状高分子化合物.请回答相关问题:
是人体生理活动的一种代谢产物.以下是采用化学方法对乳酸进行加工处理的过程,其中A、H、G为链状高分子化合物.请回答相关问题: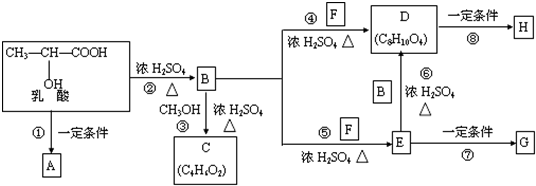
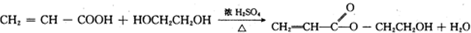
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 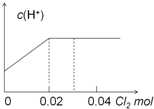 | B. | 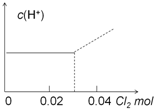 | ||
| C. | 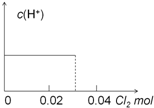 | D. | 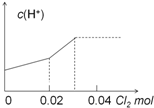 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验 | 现象 | 结论 |
| A | 取少量食盐溶于水,加稀硫酸酸化,再滴入淀粉溶液 | 溶液未呈蓝色 | 该食盐中不含有碘酸钾 |
| B | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡、静置 | 下层溶液显紫红色 | Fe3+的氧化性大于I2 |
| C | 向蛋白质溶液中加入CuCl2或(NH4)2SO4饱和溶液 | 均有沉淀 | 蛋白质均发生了变性 |
| D | 将0.1mol•L-1 MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol•L-1CuSO4溶液 | 白色沉淀逐渐变为蓝色沉淀 | Ksp[Cu(OH)2]< Ksp[Mg(OH)2] |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的单质一定是由还原该元素的化合物来制得 | |
| B. | 含有最高价元素的化合物不一定具有很强的氧化性 | |
| C. | 阳离子只能得到电子被还原,阴离子只能失去电子被氧化 | |
| D. | 在化学反应中,得电子越多的氧化剂,其氧化性就越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨易溶解于水,因此可用来作喷泉实验 | |
| B. | 与金属反应时,稀HNO3可能被还原为更低价态,则稀HNO3氧化性强于浓HNO3 | |
| C. | 铵盐受热易分解,因此贮存氨态氮肥时要密封保存,并放在阴凉通风处 | |
| D. | 实验室可用氢氧化钠溶液处理含有二氧化硫和氯气的尾气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{8b-3a}{2V}$mol•L-1 | B. | $\frac{8b-3a}{V}$mol•L-1 | C. | $\frac{a-2b}{V}$mol•L-1 | D. | $\frac{a-2b}{2V}$mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 1.20 | 16.21 |
| 2 | 3.00 | 18.90 |
| 3 | 4.50 | 19.49 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com