

| A. | 图①表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积的关系图.则三种离子的物质的量之比为:n(Mg2+):n(Al3+):n( NH4+)=2:3:2 | |
| B. | 图①中使用的NaOH的浓度为2 mol/L | |
| C. | 图②表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 | |
| D. | 图③中曲线表示3H2(g)+N2(g)═2NH3(g)反应过程的能量变化.若使用催化剂,B点会降低 |
分析 由图①可知,原溶液含有Mg2+、Al3+、NH4+,沉淀最大时是氢氧化镁、氢氧化铝沉淀,且n[Mg(OH)2]+n[Al(OH)3],沉淀最小时,为氢氧化镁,由图可知n[Mg(OH)2]=0.05mol,35mL-40mL发生Al(OH)3+OH-=AlO2-+2H2O,根据铝元素守恒可知n(Al3+)=n[Al(OH)3],根据Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓计算NaOH的浓度;再根据25mL-35mL发生NH4++OH-=NH3.H2O,以此分析A、B;
20mL0.1mol/L的CH3COOH溶液和20mL 0.1mol/L NaOH溶液恰好反应得到的醋酸钠溶液显示碱性,以此分析C;
由图③可知,反应物的总能量大于生成物的总能量,为放热反应;E为活化能,使用催化剂,降低反应所需的活化能,而△H不变,以此分析D.
解答 解:A.由图可知n[Mg(OH)2]=0.05mol,设NaOH浓度为c,由Al(OH)3+OH-=AlO2-+2H2O、n(Al3+)=n[Al(OH)3],可知n(Al3+)=0.005cmol,
根据Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,0.05mol×2+0.005cmol×3=0.025cmol,解得c=10mol/L,由NH4++OH-=NH3.H2O可知,n( NH4+)=0.01L×10mol/L=0.1mol,三种离子的物质的量之比为:n(Mg2+):n(Al3+):n( NH4+)=0.05mol:0.05mol:0.1mol=1:1:2,故A错误;
B.由A的计算可知,使用的NaOH的浓度为10mol•L-1,故B错误;
C.20mL0.1mol/L的CH3COOH溶液和20mL 0.1mol/L NaOH溶液恰好反应得到的醋酸钠溶液显示碱性,此时不会实现pH=7,故C错误;
D.图②中曲线表示某反应过程的能量变化,若使用催化剂,降低反应所需的活化能,而△H不变,即E值会减小,故D正确;
故选D.
点评 本题考查离子反应的计算及反应中能量变化,为高频考点,把握图中发生的反应及反应的先后顺序为解答的关键,侧重分析与计算能力的综合考查,题目难度中等.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:选择题
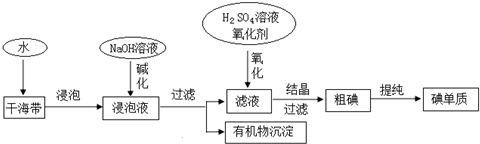
| A. | 因海水中蕴藏着极其丰富的碘元素,所以工业上也可以直接用海水来提取碘元素 | |
| B. | 碱化操作时,加入NaOH溶液的原因是在碱性溶液中,可溶性有机质可形成沉淀 | |
| C. | 在实验室进行氧化操作时,加入的氧化剂可以是新制氯水、双氧水等 | |
| D. | 在实验室进行过滤操作时,需要用到玻璃仪器有玻璃棒、烧杯、漏斗 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水、液氯都含有氯气分子,均为混合物 | |
| B. | SiO2与Al2O3都既可以与酸又可以与碱反应,故都是两性氧化物 | |
| C. | 胶体与溶液的分散质粒子均可以通过滤纸 | |
| D. | 氢氟酸可用于刻蚀玻璃,是利用SiO2酸性氧化物的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②③⑤ | C. | ③④⑤ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Si、P、S、Cl元素的单质与氢气化合越来越容易 | |
| B. | 非金属元素的非金属性越强,其氧化物对应水化物的酸性也一定越强 | |
| C. | 元素原子最外层电子数越多,元素金属性越强 | |
| D. | F-、O2-、Mg2+、Na+离子半径逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0Ll.0mol.L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 丙烯和环丙烷组成的42g混合气体中氢原子的个数为6NA | |
| C. | 25C时pH=11的Na2C03溶液中水电离出的OH-的数目为0.001NA | |
| D. | 氧原子总数为0.2NA的S02和O2的混合气体,其体积为2.24L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 刚玉--SiO2 | B. | 明矾--Al2(SO4)3•12H2O | ||
| C. | 小苏打--Na2CO3 | D. | 漂白粉--Ca(ClO)2、CaCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com