
【题目】700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g) + H2O(g)![]() CO2 (g)+ H2(g) 反应过程中不同条件下达到平衡时测定的部分数据见下表(表中t1>t2):
CO2 (g)+ H2(g) 反应过程中不同条件下达到平衡时测定的部分数据见下表(表中t1>t2):
反应时间/min | n(CO)/mol | n(H2O)/ mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说不正确的是( )
A. 反应在t1min内的平均速率为v(H2)=0.40/t1 mol·L-1·min-1
B. 保持其他条件不变,起始时向容器中充入0.60 molCO和1.20 molH2O,到达平衡时,n(CO2)=0.40 mol
C. 保持其他条件不变,向平衡体系中再通入0.20 mol H2O(g),与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大
D. 温度升至800℃,上述反应平衡常数变为1.64,则正反应为吸热反应
【答案】A
【解析】试题分析:A.v(CO)=![]() mol/(Lmin),化学反应速率之比等于化学计量数之比,则v(H2)=v(CO)=
mol/(Lmin),化学反应速率之比等于化学计量数之比,则v(H2)=v(CO)=![]() mol/(Lmin),故A错误;B.CO与H2O按物质的量比1:1反应,充入0.60 mol CO和1.20 mol H2O与充入1.20 mol CO和0.6mol H2O,平衡时生成物的浓度对应相同,t1min时n(CO)=0.8mol,n(H2O)=0.6mol-0.4mol=0.2mol,t2min时n(H2O)=0.2mol,说明t1min时反应已经达到平衡状态,根据化学方程式可知,则生成的n(CO2)=0.4mol,故B正确;C.保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,平衡向右移动,达到新平衡时CO转化率增大,H2O转化率减小,H2O的体积分数会增大,故C正确;D.t1min时反应已经达到平衡状态,此时c(CO)=
mol/(Lmin),故A错误;B.CO与H2O按物质的量比1:1反应,充入0.60 mol CO和1.20 mol H2O与充入1.20 mol CO和0.6mol H2O,平衡时生成物的浓度对应相同,t1min时n(CO)=0.8mol,n(H2O)=0.6mol-0.4mol=0.2mol,t2min时n(H2O)=0.2mol,说明t1min时反应已经达到平衡状态,根据化学方程式可知,则生成的n(CO2)=0.4mol,故B正确;C.保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,平衡向右移动,达到新平衡时CO转化率增大,H2O转化率减小,H2O的体积分数会增大,故C正确;D.t1min时反应已经达到平衡状态,此时c(CO)=![]() =0.4mol/L,c(H2O)=
=0.4mol/L,c(H2O)=![]() =0.1mol/L,c(CO2)=c(H2)=
=0.1mol/L,c(CO2)=c(H2)=![]() =0.2mol/L,则k=
=0.2mol/L,则k=![]() =1,温度升至800℃,上述反应平衡常数为0.64,说明温度升高,平衡是向左移动的,那么正反应应为放热反应,故D正确;故选A。
=1,温度升至800℃,上述反应平衡常数为0.64,说明温度升高,平衡是向左移动的,那么正反应应为放热反应,故D正确;故选A。


 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。根据要求回答问題。
(1)生活中明矾常作净水剂,其净水的原理是_____________(用离子方程式表示)。
(2)常温下,取0.2 mol/L HCl溶液与0.2mol/L MOH溶液等体积混合,测得混合后溶液的pH=5。写出MOH的电离方程式:__________________。
(3)0.1mol/L的NaHA溶液,测得溶液显碱性。则
① 该溶液中 c(H2A)_______________c(A2-)(填“>”、“<”或“=”)
② 作出上述判断的依据是_____________(用文字解释)。
(4)含Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3 mol/L的Cr2O72-。为了使废水的排放达标,进行如下处理:
![]()
绿矾为FeSO4 7H2O。反应(I)中Cr2O72-与FeSO4的物质的量之比为___________。
常温下若处理后的废水中c(Cr3+)=6.0×10-7mol/L,则处理后的废水的 pH=___________。
{Ksp[Cr(OH)3]=6.0×10-31}
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌,某硫化锌精矿的主要成分是ZnS (还含有少量FeS等其它成分),以其为原料冶炼锌的工艺流程如图所示:
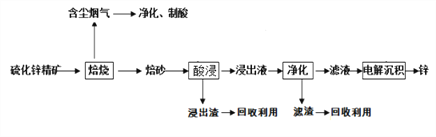
回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为___________。
浸出液净化过程中加入的主要物质是锌粉,其作用是___________________。
(2)电解沉积过程中的阴极采用铝板,阳极采用情性电极,阳极的电极反应式是______________。
(3)在该流程中可循环使用的物质是Zn和_________。
(4)改逬的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质,“氧压酸浸”中发生主要反应的离子方程式为_________________。
(5)硫化锌精矿(ZnS )遇到硫酸铜溶液可慢慢的转化为铜蓝(CuS)。请解释该反应发生的原理______________________________________________________。
(6)我国古代曾采用“火法”工艺冶炼锌。明代宋应星著的《天工开物》中有关于“升炼倭铅”的记载:“炉甘石十斤,装载入一尼罐内,……,然后逐层用煤炭饼垫盛,其底铺薪,发火锻红,….,冷淀,毀罐取出,…即倭铅也。”该炼锌工艺主要反应的化学方程式为__________________________(注:炉甘石的主要成分为碳酸锌,倭铅是指金属锌)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是
A.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
C.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol,则H2SO4和Ca(OH)2反应的中和热
ΔH=2×(-57.3)kJ·mol-1
D.500℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可由乙苯生产苯乙烯,反应原理如下:![]()
下列说法正确的是
A. 酸性高锰酸钾溶液和溴水都可以用来鉴别乙苯和苯乙烯
B. 乙苯、苯乙烯均能发生取代反应、加聚反应,氧化反应
C. 乙苯的一氯取代产物有共有5种
D. 乙苯和苯乙烯分子内共平面的碳原子数最多均为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氡是放射性元素,氡气吸入人体有害健康。氡的原子序数是86,相对原子质量是222。科学家还发现某些放射性矿物分解放出的“锕射气”是由质子数为86、质量数为219的原子组成。下列关于氡的说法正确的是( )
A. 氡气在标准状况下的密度 9.91 g·L-1
B. 氡气的化学性质较活泼,因此对人体有害
C. 氡原子核外有7个电子层,最外层有8个电子
D. “锕射气”是氡的同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是:( )
A. c(NH4+)=c(SO42-) B. c(NH4+)>c(SO42-)
C. c(NH4+)<c(SO42-) D. c(OH-)+c(SO42-) = c(NH4+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2与SO2能发生反应:NO2+SO2![]() SO3+NO,某研究小组对此进行相关实验探究。
SO3+NO,某研究小组对此进行相关实验探究。
(1)已知:2NO(g)+O2(g) ![]() 2NO2(g) △H=-113.0 kJ mol-1
2NO2(g) △H=-113.0 kJ mol-1
2SO2(g)+O2(g) ![]() 2SO3(g) △H=-196. 6 kJ mol-1
2SO3(g) △H=-196. 6 kJ mol-1
则NO2(g)+SO2(g) ![]() SO3(g)+N0(g) △H= ________.
SO3(g)+N0(g) △H= ________.
(2)实验中,尾气可以用碱溶液吸收。NaOH溶液吸收N02时,发生的反应为:
2NO2+2OH- =NO2- +NO3- +H2O,反应中形成的化学键是________(填化学键的类型);用NaOH溶液吸收少量SO2的离子方程式为____________。
(3)在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n0(NO2) : n0 (SO2)] 进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[a(NO2)]。 部分实验结果如图所示:
①当容器内_______(填标号)不再随时间的变化而改变时,可以不断反应达到了化学平衡状态。
a.气体的压强
b.气体的平均摩尔质量
c.气体的密度
d.NO2的体积分数
②如果要将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是________。

③若A点对应实验中,S02(g)的起始浓度为c0 molL-1 ,经过t min达到平衡状态,该时段化学反应速率![]() (N02)= _________molL-1min -1.
(N02)= _________molL-1min -1.
④图中C、D两点对应的实验温度分别为Tc和Td,通过计算判断::Tc_____Td(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,0.1molNa2CO3与盐酸混合所得的一组体积为1L的溶液,溶液中部分微粒与pH的关系如下图所示。下列有关溶液中离子浓度关系叙述正确的是
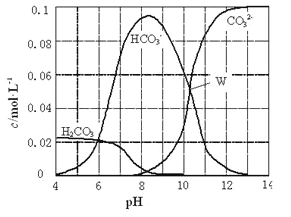
A. W点所示的溶液中:c (Na+)+c (H+)=2c(CO32-)+c (OH-)+c (Cl-)
B. pH=8的溶液中:c (H+)+c (H2CO3)+c (HCO3-)= c (OH-)+c (Cl-)
C. pH= 4的溶液中:c (H2CO3)+c (HCO3-)+c (CO32-)<0.1mol·L-1
D. pH=11的溶液中:c (Na+)>c (Cl-)>c (CO32-)>c (HCO3-)>c (H2CO3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com