
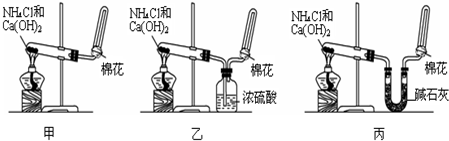
分析 (1)实验室用氢氧化钙和氯化铵在加热条件下制备氨气,反应方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)根据氨气的溶解性和密度选择收集氨气的方法;
(3)氨气能与硫酸反应而被硫酸吸收;
(4)氨气为碱性气体,与水反应生成NH3•H2O,电离子出OH-离子,溶液呈碱性;
(5)碳酸氢铵加热分解生成氨气、二氧化碳和水,可以用碱石灰除杂.
解答 解:(1)实验室用氢氧化钙和氯化铵在加热条件下制备氨气,反应方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;
(2)氨气易溶于水,不能用排水法收集,氨气密度比空气小,应用向下排空法收集,故选:BD,
故答案为:BD;
(3)氨气为碱性气体,通过盛有浓硫酸的洗气瓶时,与硫酸反应而被吸收,乙收集不到氨气,反应方程式为:2NH3+H2SO4=(NH4)2SO4,
故答案为:乙;氨气为碱性气体,通过盛有浓硫酸的洗气瓶时,与硫酸反应而被吸收;2NH3+H2SO4=(NH4)2SO4;
(4)氨气为碱性气体,与水反应生成NH3•H2O,电离子出OH-离子,溶液呈碱性,检验时可用用蘸有浓盐酸的玻璃棒靠近试管口,如果产生白烟,则氨气已满,或用湿润的红色石蕊试纸靠近试管口,如果试纸变蓝,则氨气已满,故选:C;
(5)碳酸氢铵受热分解生成氨气、水和二氧化碳.甲收集到的是混合气体,得不到纯净氨气,乙分解得到二氧化碳、氨气和水蒸气通过浓硫酸氨气被吸收得不到氨气,丙分解得到二氧化碳、氨气和水蒸气,通过碱石灰,吸收二氧化碳和水蒸气得到纯净干燥的氨气,故答案为:丙.
点评 本题考查了氨气的制取、干燥及收集,根据氨气的性质选取干燥剂,根据氨气的溶解性及密度确定收集方法,知道形成喷泉实验的条件,并不是只有氨气才能形成喷泉实验,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ClCH2CH═CH2+NaOH$→_{△}^{H_{2}O}$HOCH2CH═CH2+NaCl | |
| B. | CH2═CHCH3+Cl2→CH2ClCHClCH3 | |
| C. | 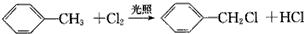 | |
| D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NO3-、AlO2-、K+、Na+ | B. | Ba2+、NH4+、Cl-、NO3- | ||
| C. | Mg2+、SO42-、K+、NO3- | D. | Fe2+、Al3+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
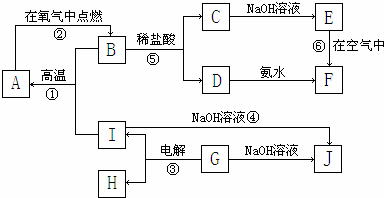
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 2010年12月,一个小学生关于对漂白蘑菇的调查再次引发了人们对滥用漂白剂漂白食品的担忧.曾有不良商贩用过氧化氢漂白食品的记录.下列有关过氧化氢(图是过氧化氢的分子结构)的说法,正确的是( )
2010年12月,一个小学生关于对漂白蘑菇的调查再次引发了人们对滥用漂白剂漂白食品的担忧.曾有不良商贩用过氧化氢漂白食品的记录.下列有关过氧化氢(图是过氧化氢的分子结构)的说法,正确的是( )| A. | 过氧化氢是离子化合物 | |
| B. | 过氧化氢分子既含有非极性键又含有极性键 | |
| C. | 过氧化氢分子只含有极性键 | |
| D. | 过氧化氢分子只含有非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200mL 0.1mol/L NH4Cl溶液 | B. | 50mL 0.2mol/L NH4NO3溶液 | ||
| C. | 100mL 0.2mol/L NH3•H2O溶液 | D. | 100mL 0.2mol/L (NH4)2SO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,则该有机物核磁共振氢谱有3个峰.
,则该有机物核磁共振氢谱有3个峰.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.4 g二氧化碳含有的分子数为0.1NA | |
| B. | 锌从盐酸中置换出1 mol H2,电子转移数为NA | |
| C. | 常温常压下,11.2 L氧气含有的原子数为NA | |
| D. | 1 mol•L-1CaCl2溶液中含有的氯离子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com