
分析 (1)砖瓦是用含铁元素等杂质的粘土隔绝空气烧制而成的,砖块中的铁以氧化亚铁的形式存在,因而砖呈青色,而砖瓦呈红色说明含红色的氧化铁;
(2)证红砖中含有三价铁,红砖溶于盐酸后、加KSCN溶液,观察是否为血红色,以此来解答.
解答 解:(1)砖瓦是用含铁元素等杂质的粘土隔绝空气烧制而成的,砖块中的铁以氧化亚铁的形式存在,因而砖呈青色,而砖瓦呈红色说明含红色的氧化铁,则捅开窑顶,空气进入窑内,铁元素被氧化生成Fe2O3而呈红色;
故答案为:捅开窑顶,空气进入窑内,铁元素被氧化生成Fe2O3而呈红色;
(2)浓硫酸具有强氧化性,可氧化亚铁离子,则应把红砖磨碎后加入稀盐酸溶解反应后得到的溶液中滴入几滴KSCN溶液,溶液变红色可证明Fe3+存在,则最简捷的方法为砸碎红砖,取少量放入研钵内,研成粉末,取该粉末放入试管中,向其中加入3mol•L-1的盐酸,振荡,静置,然后加入几滴KSCN溶液,溶液变红色证明Fe3+存在,
故答案为:砸碎红砖,取少量放入研钵内,研成粉末,取该粉末放入试管中,向其中加入3mol•L-1的盐酸,振荡,静置,然后加入几滴KSCN溶液,溶液变红色证明Fe3+存在.
点评 本题考查物质的成分的实验测定,为高频考点,把握物质的性质、发生的反应及离子检验等为解答的关键,侧重分析与应用能力的能力,注意信息的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | v(H2)=0.03 mol/(L•min) | B. | v(N2)=0.02 mol/(L•min) | ||
| C. | v(NH3)=0.17 mol/(L•min) | D. | v(NH3)=0.01 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | H-H | H-Cl | H-Br | CI-CI | Br-Br |
| 键能( KJ•mol-1) | 436 | 431 | 299 | 247 | 193 |
| A. | HCl | B. | HBr | C. | H2 | D. | Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| l键能/kJ•mol | 460 | 360 | 436 | 431 | 176 | 347 |
| A. | +412 kJ•mol-1 | B. | -412 kJ•mol-1 | C. | +236 kJ•mol-1 | D. | -236 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 橡胶一定属于合成材料 | |
| B. | 豆油、花生油、牛油都属于酯类 | |
| C. | 区别植物油、矿物油可以加水后振荡,观察其是否分层 | |
| D. | 1 mol乙醇与足量的钠反应可以生成3 mol的氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
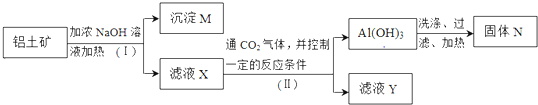
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
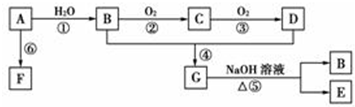
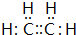 ;C的分子式:C2H4O;D中的官能团:羧基.
;C的分子式:C2H4O;D中的官能团:羧基.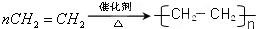 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Zn为正极,Cu为负极 | B. | Cu片上发生氧化反应 | ||
| C. | 电子由铜片通过导线流向锌片 | D. | 正极反应为 2H++2e-═H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com