
����Ŀ������Ҫ��д�����з�Ӧ�ķ���ʽ��
��1��Al�ۺ�NaOH��Һ��Ӧ�Ļ�ѧ����ʽ��_____
��2��Ư��¶���ڿ����нϳ�ʱ���ʧЧ�Ļ�ѧ����ʽ��_____
��3�����ۺ�ˮ������Ӧ��ѧ����ʽ��_____
��4��Cl2ͨ��NaOH��Һ�У�������Ӧ�����ӷ���ʽ��_____
��5�����������������ԭ��____________________________________________________
��6��SO2ͨ�����Ը��������Һ�е����ӷ���ʽ____________________________________
��7�������귢ׯ�ڡ��漰�Ļ�ѧ��Ӧ����ʽ_______________________________________
���𰸡�2Al+2NaOH+2H2O��2NaAlO2+3H2�� Ca��ClO��2+H2O+CO2��CaCO3��+2HClO��2HClO![]() 2HCl+O2�� 3Fe+4H2O��g��
2HCl+O2�� 3Fe+4H2O��g��![]() Fe3O4+4H2 Cl2+2OH����ClO��+Cl��+H2O SO2+H2O
Fe3O4+4H2 Cl2+2OH����ClO��+Cl��+H2O SO2+H2O![]() H2SO3��2H2SO3+O2��2H2SO4 5SO2+2MnO4-+2H2O��5SO42-+2Mn2++4H+ N2��O2
H2SO3��2H2SO3+O2��2H2SO4 5SO2+2MnO4-+2H2O��5SO42-+2Mn2++4H+ N2��O2![]() 2NO��2NO��O2��2NO2��3NO2��H2O��2HNO3��NO
2NO��2NO��O2��2NO2��3NO2��H2O��2HNO3��NO
��������
�������ʵ����ʡ���Ӧ����������ԭ���غ㡢����غ��Լ����ʵIJ�������д��ѧ����ʽ�����ӷ�Ӧ����ʽ��
��1��Al�ۺ�NaOH��Һ��Ӧ����ƫ�����ƺ���������Ӧ�Ļ�ѧ����ʽΪ2Al+2NaOH+2H2O��2NaAlO2+3H2����
��2��Ư��¶���ڿ����нϳ�ʱ���ʧЧ����Ϊ����������տ����е�ˮ�����Ͷ�����̼���ɴ����ᣬ������ȶ��ֽ����£���Ӧ�Ļ�ѧ����ʽΪCa(ClO)2+CO2+H2O��CaCO)3+2HClO��2HClO![]() 2HCl+O2����
2HCl+O2����
��3�����ۺ�ˮ������Ӧ������������������������Ӧ�Ļ�ѧ����ʽΪ3Fe+4H2O(g)![]() Fe3O4+4H2��
Fe3O4+4H2��
��4��Cl2ͨ��NaOH��Һ�������Ȼ��ơ��������ƺ�ˮ��������ˮ�û�ѧʽ��ʾ��������Ӧ�����ӷ���ʽΪCl2+2OH-��Cl-+ClO-+H2O��
��5������������ˮ��Ӧ���������ᣬ�������ױ�����Ϊ���ᣬ�����������������ԭ���÷���ʽ��ʾΪSO2+H2O![]() H2SO3��2H2SO3+O2��2H2SO4��
H2SO3��2H2SO3+O2��2H2SO4��
��6�����������ױ����������Һ����Ϊ���ᣬ��SO2ͨ�����Ը��������Һ�е����ӷ���ʽΪ5SO2+2MnO4-+2H2O��5SO42-+2Mn2++4H+��
��7�������ڷŵ���������������������NO��NO����������NO2��NO2����ˮ�������ᣬ�����귢ׯ�ڡ��漰�Ļ�ѧ��Ӧ����ʽΪN2��O2![]() 2NO��2NO��O2��2NO2��3NO2��H2O��2HNO3��NO��
2NO��2NO��O2��2NO2��3NO2��H2O��2HNO3��NO��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������л�����жϴ�����ǣ� ��
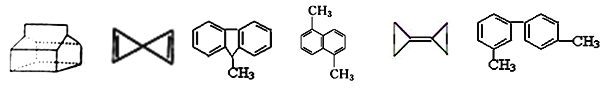
�� �� �� �� �� ��
A. �����⣬�����л������ʹ���Ը��������Һ��ɫ
B. �ۢܢ������ڷ��������ܢ������ϵ�һ������ͬ���칹����Ŀ����6��
C. �ڢ���һ�ȴ����ֻ��һ�����ٵ�һ�ȴ������������ܱ����ϵĶ��ȴ�����9����
D. �ܢݢ�������̼ԭ�ӿ��ܴ���ͬһƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧʵ��С���ͬѧΪ̽���ͱȽ�SO2����ˮ��Ư���ԣ���������µ�ʵ��װ�á���ش��������⣺
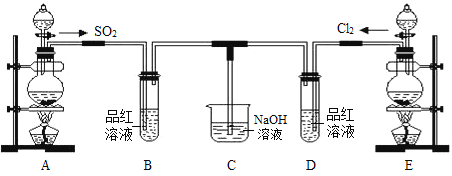
��1��ʵ������װ��E�Ʊ�Cl2���䷴Ӧ�Ļ�ѧ����ʽΪMnO2+4HCl(Ũ) ![]() MnCl2 + Cl2�� + 2H2O����������ѧ����ʽ��дΪ���ӷ���ʽ_______________________________��
MnCl2 + Cl2�� + 2H2O����������ѧ����ʽ��дΪ���ӷ���ʽ_______________________________��
��2���ٷ�Ӧ��ʼһ��ʱ��۲쵽B��D�����Թ��е�Ʒ����Һ����__________��������ѡ����ţ���ͬ����
A��Ʒ����Һ����ɫ B��Ʒ����Һ������ɫ
C��B��Ʒ����Һ��ɫ��D�в���ɫ D��D��Ʒ����Һ��ɫ��B�в���ɫ
��ֹͣͨ�����ٸ�B��D�����Թֱܷ���ȣ������Թ��е���Һ���ֵ���ɫ�ֱ�Ϊ________��
A����ɫ����ɫ B����ɫ����ɫ C����ɫ����ɫ D����ɫ����ɫ
��3��C�ձ�������������Һ��������_____________________________��д��Cl2ͨ��NaOH��Һ�еĻ�ѧ����ʽ_______________________________��
��4����һ��ʵ��С���ͬѧ��ΪSO2����ˮ����Ư���ԣ�����Ϻ��Ư���Կ϶����ǿ�����ǽ��Ƶõ�SO2��Cl2�����ʵ���֮��1�U1ͬʱͨ�뵽Ʒ����Һ�У����������ɫЧ�������������������������������ԭ�������ӷ���ʽ��ʾ��_______________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ۺ�������(PFS)��һ�ָ�Ч�����߷�����������ij�������þ���ѡ������������(��Ч�ɷ�ΪFe2O3 ��Fe3O4)�Ʊ�PFS���乤����������ͼ��ʾ��

��1����ԭ���չ����У�CO��ԭFe3O4����FeO���Ȼ�ѧ����ʽΪ________________________��
��֪�� Fe3O4(s)+C(s)= 3FeO(s)+CO(g) ��H1=+191.9kJ��mol-1
C(s)+O2(g)=CO2(g) ��H2=-393.5kJ��mol-1
C(s)+CO2(g)=2CO(g) ��H3=+172.5kJ��mol-1
��2��CO�ǻ�ԭ���չ��̵���Ҫ��ԭ������ͼ�У����߱�ʾ4����ѧ��Ӧa��b��c��d�ﵽƽ��ʱ������ɺ��¶ȵĹ�ϵ��I�����ֱ���Fe2O3��Fe3O4��FeO��Fe�ȶ����ڵ�����a����_________������ȷ�Ӧ�����ȷ�Ӧ������570��ʱ��d��Ӧ��ƽ�ⳣ��K= ____________��

��3����ҵ�ϣ���ԭ���յ��¶�һ�������800�����ң��¶Ȳ��˹��ߵ�������___________________��
��4�����������ʱ�����������Һ��Fe2+�����������ͣ���Ҫԭ����___________________________��
��5��FeSO4��Һ�ڿ����лỺ�������������ܵ�Fe(OH)SO4���÷�Ӧ�����ӷ���ʽΪ_____________________________������������������NaNO2��������NO��ʵ���ϵĴ����ã�ʱ���¶���Fe2+ת���ʵĹ�ϵ����ͼ��ʾ����Ӧʱ����ͬ����Fe2+ת�������¶ȵ��������������½���ԭ����___________________________________________________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ӣ���ͼ�����������壬����ˮ�⣬�ڵ�����ҵ�������Ź㷺��;�������й�SF6���Ʋ���ȷ���ǣ�������
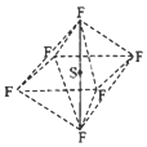
A. ���������£�SF6��ˮ������H2SO4��HF
B. SF6��ȼ�����ɶ�������
C. SF6�и�ԭ�Ӿ��ﵽ 8 �����ȶ��ṹ
D. ������������е�S��F�����ǦҼ������������ܲ���ȫ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ʣ�����������ʡ������˳�����е���(����)
A. �ռҺ̬�����ɱ� B. ��ʯ�ҡ����ס�Ư��
C. ��ˮ�����졢�Ȼ��� D. ����������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NH4N3(�������)������ը��Ӧ: NH4N3![]() 2N2��+2H2����NAΪ�����ӵ�������ֵ������˵����ȷ����
2N2��+2H2����NAΪ�����ӵ�������ֵ������˵����ȷ����
A. 1.8gNH4+�к��е�������Ϊ1NA
B. N2��������������ǻ�ԭ����
C. ��ը��Ӧ�У���ת��4NA������ʱ,����89.6L (��״̬)�������
D. 6g��NH4N3�����к��е������Ӹ���Ϊ0.3NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��ĵ����ס���(As)��Ԫ���ڻ������г����ֳ���������̬������A��Ԫ�صĻ�������ҽҩ��������������Ҫ��;����ش��������⣺
��1������ͬ���ڵڢ�A�����ĵ�һ��������ȣ��ϴ����_______________________��
��2����̬�⻯���ȶ��ԣ�NH3 ______________ AsH3������Ҫԭ����___________________��
��3������(N2H4)���ӿ���ΪNH3�����е�һ����ԭ�ӱ�NH2(����)ȡ���γɵ���һ�ֵ����⻯���N2H4����ʽΪ_______________��
�ڹ�ҵ�Ͻ�NH3��(CH3)2CO��������Ӧ��ˮ����ȡN2H4��(CH3)2CO��̼ԭ�ӹ�����ӻ�����Ϊ_______________��1 mol(CH3)2 CO�еĦм���ĿΪ___________��
��N2H4�����д��ڵĹ��ۼ�������________(��ѡ����ĸ)��
A���Ǽ��Լ� B�����Լ� C��s��s �Ҽ� D��s��p �Ҽ�
E��p��p �м� F��s��sp3 �Ҽ� G��sp3��sp3 �Ҽ� H��sp3��sp3 �м�
��4����֪N2H5+��N2H62+�������Է��ӽ�������γɵ�,�������� NH4+�����ʡ�
��д��N2H62+�ڼ�����Һ�з�Ӧ�����ӷ���ʽ��_________________________________��
�ھݱ�����������ѧ�ҿ���������˹����1998��11�ºϳ���һ����Ϊ��N5�������ʣ�ֻ֪����N5��ʵ�����Ǵ�����ɵķ�����Ƭ����ṹ�ǶԳƵģ�5��N�ų�V�Ρ����5��N��Ϻﵽ8���ӽṹ���Һ���2��N��N������N5��������Ƭ���������____________��
��5��Na3AsO4����ɱ�����AsO![]() �Ŀռ乹��Ϊ__________�����以Ϊ�ȵ������һ�ַ���Ϊ________��
�Ŀռ乹��Ϊ__________�����以Ϊ�ȵ������һ�ַ���Ϊ________��
��6��ij����������׳ơ���˪��������ӽṹ��ͼ��ʾ���û�����ķ���ʽΪ__________����ԭ�Ӳ�ȡ___________�ӻ���
 .
.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����͵�������������ʱ�������з�Ӧ��4Li+2SOCl2��4LiCl+S+SO2�������й��ж���ȷ���ǣ���ʾ��SOCl2��S��![]() �ۣ�
�ۣ�
A. ��ԭ��ֻ��Li
B. SOCl2�������������ǻ�ԭ��
C. ��ԭ�������LiCl��S
D. ����1.12LSO2ʱ����Ӧת�Ƶ���Ϊ0.2mol
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com