
 .
.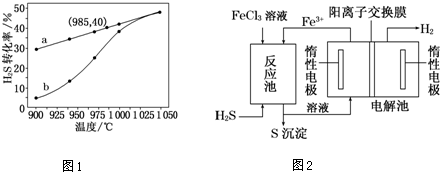
分析 (1)元素M、R均位于元素周期表中第3周期,两种元素原子的质子数之和为27,结合K2O•M2O3•2RO2•nH2O可知,M的最外层电子数为3,R的最外层电子数为4,则M为Al,R为Si;
(2)985℃时H2S达到平衡时转化率为40%,则
H2S(g)═H2(g)+$\frac{1}{2}$S2(g)
开始 c 0 0
转化 0.4c 0.4c 0.2c
平衡 0.6c 0.4c 0.2c
结合平衡浓度计算K;
(3)反应池中氯化铁与硫化氢反应生成氯化亚铁、S和HCl;电解池中亚铁离子与氢离子反应生成氢气和铁离子,以此来解答.
解答 解:(1)元素M、R均位于元素周期表中第3周期,两种元素原子的质子数之和为27,结合K2O•M2O3•2RO2•nH2O可知,M的最外层电子数为3,R的最外层电子数为4,则M为Al,R为Si,Si的原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)985℃时H2S达到平衡时转化率为40%,则
H2S(g)═H2(g)+$\frac{1}{2}$S2(g)
开始 c 0 0
转化 0.4c 0.4c 0.2c
平衡 0.6c 0.4c 0.2c
K=$\frac{0.4c×\sqrt{0.2c}}{0.6c}$=$\frac{2}{3}\sqrt{0.2c}$,
故答案为:$\frac{2}{3}\sqrt{0.2c}$;
(3)反应池中氯化铁与硫化氢反应生成氯化亚铁、S和HCl,反应为2FeCl3+H2S═2FeCl2+S+2HCl;电解池中亚铁离子与氢离子反应生成氢气和铁离子,电解离子反应为 2Fe2++2H+$\frac{\underline{\;电解\;}}{\;}$H2↑+2Fe3+,
故答案为:2FeCl3+H2S═2FeCl2+S+2HCl;2Fe2++2H+$\frac{\underline{\;电解\;}}{\;}$H2↑+2Fe3+.
点评 本题考查化学平衡计算及电解,为高频考点,把握化学平衡三段法、K的计算、电解反应为解答的关键,侧重分析与计算能力的考查,注意利用平衡浓度计算K,题目难度中等.


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:解答题
 将不可再生的天然气、石油、煤等化石燃料转化利用、变废为宝已成为当务之急.
将不可再生的天然气、石油、煤等化石燃料转化利用、变废为宝已成为当务之急.| 化学键 | C-H | C-F | H-F | F-F |
| 键能/(kJ•mol-1) | 414 | 489 | 565 | 155 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12.8 g | B. | 19.2 g | C. | 32.0 g | D. | 38.4 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 温度/℃ | K1 | K2 |
| 500 | 1.00 | 3.15 |
| 700 | 1.47 | 2.26 |
| 900 | 2.40 | 1.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入KSCN溶液,溶液变红,证明原溶液含有Fe3+ | |
| B. | 将气体通入KMnO4酸性溶液,紫色褪色,证明气体为乙烯 | |
| C. | 将气体通入澄清石灰水,有白色沉淀,证明气体为CO2 | |
| D. | 加入BaCl2溶液,沉淀不溶于盐酸,证明原溶液含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
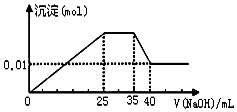 某无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+,NO3-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
某无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+,NO3-、CO32-、SO42-,现取三份100mL溶液进行如下实验:| A. | 依据电荷守恒,原溶液中NO3-的物质的量应为0.03mol | |
| B. | 原溶液一定不存在H+、Cu2+、CO32- | |
| C. | 原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+):n(Al3+):n(NH4+)=1:1:2 | |
| D. | 实验所加的NaOH的浓度为2mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质熔点 Al>Mg>K>Na>Li | B. | 沸点 HI>HBr>HCl>HF | ||
| C. | 酸性 HClO4>H2SO4>H3PO4>H2SiO3 | D. | 稳定性 AsH3>PH3>NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K3C60中既有离子键,又有极性键 | |
| B. | 该物质在熔融状态下能导电 | |
| C. | 该物质的化学式写成KC20 | |
| D. | 1mol K3C60中含有的离子键的数目为3NA个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com