


 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源:不详 题型:填空题
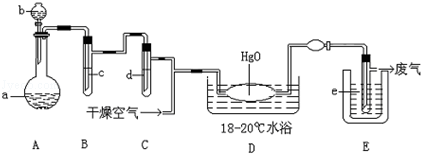
 2CaO+2S02↑+O2↑。
2CaO+2S02↑+O2↑。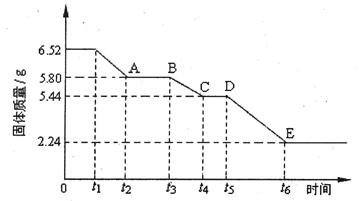
查看答案和解析>>
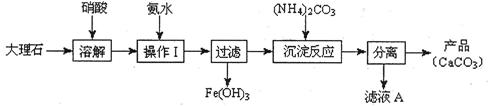
科目:高中化学 来源:不详 题型:实验题
| A.分液法 | B.蒸馏法 | C.过滤 | D.结晶法 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
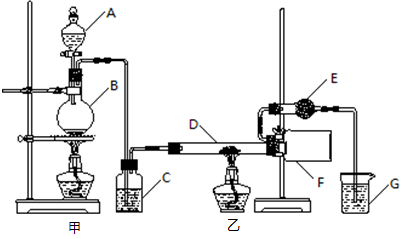
查看答案和解析>>
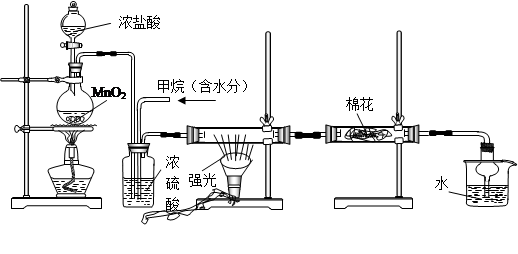
科目:高中化学 来源:不详 题型:单选题
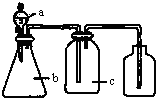
| 编号 | 气体 | a | b | c |
| A | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| B | CO2 | 盐酸 | 碳酸钙 | 饱和NaHCO3 |
| C | NO | 稀硝酸 | 铜屑 | H2O |
| D | NO2 | 浓硝酸 | 铜屑 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Zn(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 5.6 |
| 完全沉淀pH | 4.1 | 5.2 | 8.0 |
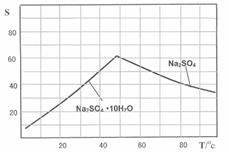
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com