
分析 ①陶瓷、水泥和普通玻璃主要成分为硅酸盐;依据制造玻璃用到的原料解答;
②无论钢铁发生吸氧腐蚀还是析氢腐蚀,它们的共同特点是铁均为负极;为防止钢铁的腐蚀,要让钢铁做原电池的正极或电解池的阴极;
③合成材料主要有塑料、合成橡胶、合成纤维;废弃塑料会形成“白色污染”;
解答 解:①陶瓷、水泥和普通玻璃主要成分为硅酸盐,所以属于硅酸盐材料,属于无机非金属材料;制造玻璃用到的原料:纯碱、石灰石和 SiO2;
故选:b; SiO2;
②无论钢铁发生吸氧腐蚀还是析氢腐蚀,它们的共同特点是铁均为负极,失电子发生氧化反应;为防止钢铁的腐蚀,要让钢铁做原电池的正极或电解池的阴极,故可以在船身上连接锌块,形成原电池,从而铁做原电池的正极而被保护,故答案为:氧化;锌块;
③三大合成材料是指:塑料、合成纤维、合成橡胶;“白色污染”是废弃塑料形成的,故答案为:合成纤维;废塑料制品.
点评 本题考查知识点较多,注重化学与生活的联系,侧重于化学与人体健康的考查,利用化学知识来解决生活中的问题即可解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 邻甲基苯酚能与NaOH溶液反应而苯甲醇不能 | |
| B. | 甲苯能使酸性高锰酸钾溶液褪色而甲烷不能 | |
| C. | 苯与液溴在催化剂存在下发生反应,而苯酚与浓溴水混合就能发生反应 | |
| D. | 等物质的量的乙醇和乙二醇与足量的金属钠反应,后者产生的氢气比前者多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
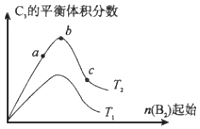
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 31.6 g高锰酸钾完全分解产生O2的体积约为2.24 L | |
| B. | 在25℃、101KPa时,24.5L氨气所含质子数约为10NA | |
| C. | 0.3 mol•L-1硫酸钠溶液中所含Na+和SO42-总物质的量为0.9 mol | |
| D. | 25℃、101KPa下,2.24 L二氧化碳与二氧化硫的混合气体中所含氧原子数约为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
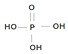 (为三元中强酸),三聚磷酸可视为三个磷酸分子之间脱去两个水分子的产物,其结构简式为
(为三元中强酸),三聚磷酸可视为三个磷酸分子之间脱去两个水分子的产物,其结构简式为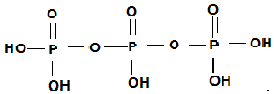 ;三聚磷酸钠是常用的水处理剂,其化学式为Na5P3O10.
;三聚磷酸钠是常用的水处理剂,其化学式为Na5P3O10.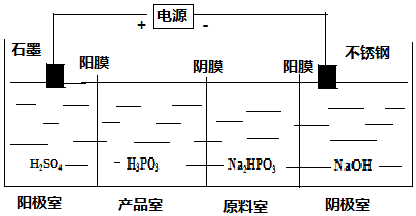
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,32 g O2占有的体积约为22.4 L | |
| B. | 氢气的摩尔质量是2g | |
| C. | 在标准状况下,22.4 L水的质量为18 g | |
| D. | 1molH2O的质量是18g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 1:2:3 | C. | 1:3:3 | D. | 3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Al3+离子含有的核外电子数为3NA | |
| B. | 1molCl2与足量的铁反应,转移的电子数为3NA | |
| C. | 10 LpH=l的硫酸溶液中含有的H+离子数为NA | |
| D. | 1L0.5mol/L的碳酸钠溶液中含有的CO32-离子数为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com