


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
A、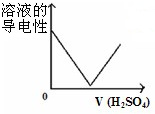 将一定量稀硫酸滴入到同浓度的Ba(OH)2溶液中 将一定量稀硫酸滴入到同浓度的Ba(OH)2溶液中 |
B、 将铁粉加入到一定量FeCl3溶液中 将铁粉加入到一定量FeCl3溶液中 |
C、 将铜粉加入到一定量浓硝酸中 将铜粉加入到一定量浓硝酸中 |
D、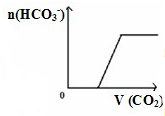 将二氧化碳通入到一定量漂粉精溶液中 将二氧化碳通入到一定量漂粉精溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| n(CH3OH) |
| n(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ | C、①③ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去混在氯化钠固体中的氯化铵或单质碘,均可用升华的方法 |
| B、若FeCl2溶液中含有I-杂质,可用过量的Cl2氧化后进行萃取分液 |
| C、CO2中含有HCl杂质:通入饱和NaHCO3溶液,洗气 |
| D、鉴别固体Na2CO3和NaHCO3,可以分别配成溶液,再加入澄清石灰水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com