
【题目】某化合物的溶液中可能含有下列离子,当加入NaOH溶液时,有沉淀生成;另取该化合物的水溶液,并加入铁粉,溶液的质量将增加。该溶液中一定含有的离子是( )
A.Ag+ B.Fe3+ C.A13+ D.Mg2+
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】向某体积固定的密闭容器中加入0.3 mol A、0.1 mol C和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:

(1)密闭容器的体积是_____L;
(2)若t1=15时,则t0~t1 s内以C物质浓度变化表示的反应速率v(C)=_______;
(3)写出反应的化学方程式:________________________;
(4)t1 s时,A的转化率为__________,此时v(A)正______v(B)逆(选填“>”、“<”或“=”);
(5)B的起始的物质的量是_____;
(6)平衡时体系内的压强为初始状态的___________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~F六种元素中,除F外其他均为短周期元素,它们的原子结构或性质如下表所示。
元素 | 原子结构或性质 |
A | 其形成的一种同位素原子在考古中可推测化石的年代 |
B | 与A同周期,其最高价氧化物的水化物无论浓、稀溶液均有强氧化性 |
C | 地壳中含量最多的元素 |
D | D原子的内层电子数是最外层电子数的5倍 |
E | 其单质主要存在于火山口附近 |
F | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
请回答下列问题:
(1)A在元素周期表中的位置是____________;A与C形成的化合物AC2的电子式是__________。
(2)下列事实能证明C和E的非金属性强弱的是 。(填序号)
①常温下,C的单质呈气态,E的单质呈固态
②C的气态氢化物的稳定性强于E的气态氢化物的稳定性
③C与E形成的化合物中,E呈正价
④E的氢化物的沸点高于C的氢化物的沸点
(3) 由A、B、C和氢元素四种元素所形成的阴、阳离子数目之比为1:1的离子化合物是 (填化学式),它与足量NaOH溶液在加热时反应的离子方程为: 。
(4) FC与足量B的最高价氧化物的水化物的稀溶液反应的离子方程式 。若有标准状况下5.6L的BC生成,则转移的电子数为 。
(5) A的氢化物有多种,1 mol A的某种氢化物分子中含有14 mol电子,已知在25℃、101kPa下,1g该氢化物在足量氧气中完全燃烧生成液态水时放出的热量为40 kJ,写出表示该氢化物燃烧热的热化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香兰素是重要的香料之一,它可由丁香酚经多步反应合成。
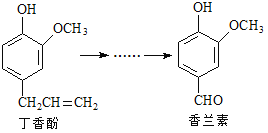
有关上述两种化合物的说法正确的是
A. 常温下1 mol丁香酚只能与1 mol Br2反应
B. 丁香酚不能与FeCl3溶液发生显色反应
C. 1 mol香兰素最多能与3 mol氯气发生加成反应
D. 香兰素分子中至少有12个原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如右图所示。关于这两种晶体的说法正确的是


A.两种晶体均为原子晶体
B.立方相氮化硼含有σ键和π键,所以硬度大
C.六方相氮化硼层结构与石墨相似却不导电的原因是层状结构中没有自由移动的电子
D.NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一.1mol NH4BF4含有1 mol配位键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种新型药物,具有血管扩张活性的选择性β1肾上腺素受体拮抗剂,用于合成该药物的中间体G的部分流程如下:
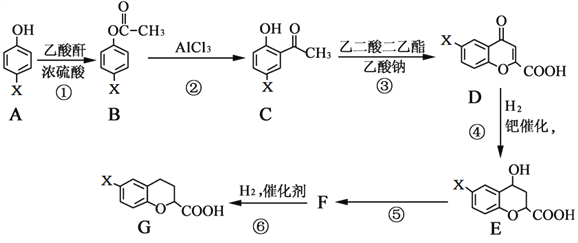
已知:乙酸酐的结构简式为:![]()
请回答下列问题:
(1)G物质中的含氧官能团的名称是________、________。
(2)反应A→B的化学方程式为_________________________________________。
(3)上述④、⑤变化过程的反应类型分别是_______________、______________。
(4)有机物F的结构简式为______________________。
(5)写出满足下列条件的C的同分异构体的结构简式:___________、___________。
Ⅰ. 苯环上只有两种取代基。
Ⅱ. 分子中只有4种不同化学环境的氢。
Ⅲ. 能与NaHCO3反应生成CO2。
(6)根据已有知识并结合相关信息,补充完成以![]() 和乙酸酐为原料制备
和乙酸酐为原料制备![]() 的合成路线流程图(无机试剂任选)。部分合成路线流程图如下:
的合成路线流程图(无机试剂任选)。部分合成路线流程图如下:

请完成合成路线_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼( N2H4)是一种高能燃料,在工业生产中用途广泛。
(1)0.5mol肼中含有__________ mol极性共价键。
(2) 肼的性质与氨气相似,易溶于水,有如下反应过程:
N2H4+H2O![]() N2H4·H2O
N2H4·H2O![]() N2H5++OH-
N2H5++OH-
①常温下,某浓度N2H5C1溶液的pH为5,则该溶液中由水电离产生的c(H+)为______mol/L。
②常温下,0.2mol/L N3H4溶液0.1mol/L HCL溶液等体积混合,混合溶液的pH>7,
则溶液中v(N2H5+)________v(N2H4·H2O)(填“>”、“<”或“=”)。
(3)工业上可用肼(N2H4)与新制Cu(OH)2反应制备纳米级Cu2O,同时放出N2,该反应的化学方程式为______________________________________。
(4)发射火箭时,肼为燃料,双氧水为氧化剂,两者反应成氮气与水蒸气。已知1.6g液态肼在上述反应中放出64.22kJ的热量,写出该反应的热化学方程式___________________。
(5)肼-双氧水燃料电池由于其较高的能量密度而广受关注,其工作原理如图所示。则电池正极反应式为_______________,电池工作过程中,A极区溶液的pH____________(填“增大”“减小”或“不变”)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com