
| A. | 增大SO2的转化率K值一定增大 | B. | 减小压强K值减小 | ||
| C. | 升高温度K值增大 | D. | K值越大SO2转化率越大 |
分析 A、平衡常数是温度的函数,温度不变K不变;
B、平衡常数是温度的函数,压强改变平衡常数不变;
C、正反应是放热反应,升高温度K值减小;
D、平衡常数k越大,说明反应进行的程度越大.
解答 解:A、增大二氧化硫的量,而温度不变,所以K不变,故A错误;
B、压强改变平衡常数不变,故B错误;
C、正反应是放热反应,升高温度K值减小,故C错误;
D、平衡常数k越大,说明反应进行的程度越大,反应物的转化率越大,故D正确;
故选D.
点评 考查平衡常数的意义、化学平衡常数的影响因素等,难度不大,注意化学平衡常数的用途:1、判断反应进行的程度,2、判断反应的热效应,3、判断反应进行的方向,4、计算转化率.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
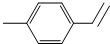 (写出分子式)C9H10
(写出分子式)C9H10查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 医疗上常用体积分数为75%的酒精作消毒剂 | |
| B. | 我国《居室空气中甲醛的卫生标准》规定,居室空气中甲醛的最高浓度为0.8mg/m3 | |
| C. | 使用加酶洗衣粉时,最好将水温控制在40~50℃ | |
| D. | 医院里给病人输液用的生理盐水浓度为0.9% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com