



 ,写出E→F的反应类型加聚反应.
,写出E→F的反应类型加聚反应. .
. .
. 分析 邻羟基苯甲酸钠和酸反应生成邻羟基苯甲酸,则A为 ,根据信息I知,B为
,根据信息I知,B为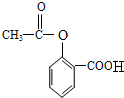 ;
;
根据缓释阿司匹林结构简式及高聚物F知,F为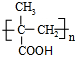 ;E发生加聚反应生成F,则E为CH2=C(CH3)COOH,D发生消去反应生成E,C发生信息II知,C为(CH3)2C=O、D为(CH3)2C(OH)COOH;
;E发生加聚反应生成F,则E为CH2=C(CH3)COOH,D发生消去反应生成E,C发生信息II知,C为(CH3)2C=O、D为(CH3)2C(OH)COOH;
根据B、F和缓释阿司匹林结构简式知,则G为HOCH2CH2OH,据此分析解答.
解答 解:邻羟基苯甲酸钠和酸反应生成邻羟基苯甲酸,则A为 ,根据信息I知,B为
,根据信息I知,B为 ;
;
根据缓释阿司匹林结构简式及高聚物F知,F为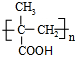 ;E发生加聚反应生成F,则E为CH2=C(CH3)COOH,D发生消去反应生成E,C发生信息II知,C为(CH3)2C=O、D为(CH3)2C(OH)COOH;
;E发生加聚反应生成F,则E为CH2=C(CH3)COOH,D发生消去反应生成E,C发生信息II知,C为(CH3)2C=O、D为(CH3)2C(OH)COOH;
根据B、F和缓释阿司匹林结构简式知,则G为HOCH2CH2OH,
(1)通过以上分析知,A结构简式为 ,E发生加聚反应生成F,所以反应类型是加聚反应,
,E发生加聚反应生成F,所以反应类型是加聚反应,
故答案为: ;加聚反应;
;加聚反应;
(2)A中含有酚羟基、阿司匹林中不含酚羟基,二者都含有羧基,所以可以用氯化铁溶液检验酚羟基,故选c;
(3)根据信息I知,A反应生成B的方程式为

(4)通过以上分析知,C的结构简式为(CH3)2C=O,故答案为:(CH3)2C=O;
(5)E发生消去反应生成E,反应方程式为 (CH3)2C(OH)COOH$→_{△}^{浓硫酸}$CH2=C(CH3)COOH+H2O,故答案为:(CH3)2C(OH)COOH$→_{△}^{浓硫酸}$CH2=C(CH3)COOH+H2O;
(6)一定条件下生成缓释阿司匹林的化学方程式为 ,
,
故答案为:
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断及知识迁移能力,根据某些物质结构简式、反应条件再结合题给信息进行推断,注意信息II中断键和成键方式,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O=H2SiO3↓+SO32- | |
| B. | 向NH4HCO3溶液中加过量NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 向Al2(SO4)3溶液中加入过量的NH3•H2O:Al3++4NH3•H2O=[Al(OH)4]-+4NH4+ | |
| D. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 刚玉(Al2O3)、金刚砂(SiC)等是耐高温材料 | |
| B. | 氨和二氧化硫易液化,可通过氨水分解吸热,使周围温度降低,可做制冷剂 | |
| C. | 浓硫酸可用于干燥SO2、NO2等气体 | |
| D. | 硅酸钠的水溶液是制备硅胶和木材防火剂的原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种原子的电子层上全部都是s电子 | |
| B. | 3p能级上只有一个空轨道的原子和3p能级上有一个未成对电子的原子 | |
| C. | 最外层电子排布式为2s22p6的原子和最外层电子排布式为2s22p6的离子 | |
| D. | 原子核外的M层上的s能级和p能级都填满了电子,而d轨道上尚未排有电子的两种原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 23gNa由原子变成离子时,失去电子数为0.2NA | |
| B. | 18gH2O所含电子数为10NA | |
| C. | 1mol氯气与足量的NaOH溶液反应,发生转移的电子数为NA | |
| D. | 在20℃、1.0×105Pa条件下,11.2L氢气所含原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸亚铁酸性溶液暴露在空气中:4Fe2++O2+4H+═4Fe3++2H2O | |
| B. | 过量石灰水与碳酸氢钙反应:Ca2++2HCO${\;}_{3}^{-}$+2OH-═CaCO3↓+CO${\;}_{3}^{2-}$+2H2O | |
| C. | 向偏铝酸钠溶液中通入过量CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO${\;}_{3}^{-}$ | |
| D. | 过量铁和稀硝酸反应:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com