
| A. | 食品中大量添加苯甲酸钠等防腐剂,可有效延长其保质期 | |
| B. | “地沟油”可以制成生物柴油,提高资源的利用率 | |
| C. | 发展光伏发电等高效清洁能源,缓解能源危机 | |
| D. | 大力发展公共交通,提高汽油的质量,对减轻雾霾很有必要 |
分析 A.添加食品防腐剂应按规定的添加量使用才安全;
B.“地沟油”可以制成生物柴油,变废为宝;
C.高效洁净能源是对生态环境低污染或无污染的能源;
D.大力发展公共交通可以减少私家车出行,有利于改善空气质量进行.
解答 解:A.添加食品防腐剂的目的是为了改善食品品质、延长保存期、方便加工和保全营养成分,按规定的添加量使用才是安全的,大量添加对人体有害,故A错误;
B.“地沟油”可以制成生物柴油,提高资源的利用率,变废为宝,故B正确;
C.清洁能源技术是指在可再生能源及新能源如煤的清洁高效利用等领域开发的对生态环境低污染或无污染的新技术,加快高效洁净能源转换技术的开发,能缓解能源危机,故C正确;
D.根大力发展公共交通可以减少私家车出行,有利于改善空气质量进行,故D正确;
故选:A.
点评 本题考查了常见食品添加剂、地沟油等生活中常见的物质的性质,环境污染与防治问题,熟悉相关知识是解题关键,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
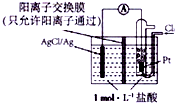
| A. | 正极为Pt电极,电极反应为2Ag++Cl2+2e-═2AgCl↓ | |
| B. | 放电时,交换膜两侧溶液中盐酸浓度不变 | |
| C. | 若用NaCl溶液代替盐酸,则电池总反应随之改变 | |
| D. | 当电路中转移0.01mole-时,交换膜左侧溶液中约减少0.02mol离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
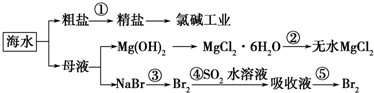
| A. | 除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 在过程②中将MgCl2•6H2O灼烧即可制得无水MgCl2 | |
| C. | 从能量转换角度来看,氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程 | |
| D. | 从第③步到第⑤步的目的是为了浓缩 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
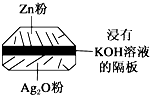 (1)铅蓄电池是典型的可充型电池,电池总反应式为:Pb+PbO2+4H++2$S{O}_{4}^{2-}$$?_{充电}^{放电}$2PbSO4+2H2O.请回答下列问题(不考虑氢、氧的氧化还原):
(1)铅蓄电池是典型的可充型电池,电池总反应式为:Pb+PbO2+4H++2$S{O}_{4}^{2-}$$?_{充电}^{放电}$2PbSO4+2H2O.请回答下列问题(不考虑氢、氧的氧化还原):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液:Na+、K+、SO42-、AlO2- | |
| B. | KW/c(OH-)=0.1mol/L的溶液:Na+、Mg2+、NO3-、S2- | |
| C. | 无色溶液:Na+、Ca2+、I-、NO3- | |
| D. | 能使甲基橙呈黄色的溶液:H+、ClO-、Fe2+、Ag+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮原子结构示意图: | B. | 乙烯的结构式:CH2CH2 | ||
| C. | 含有10个中子的氧原子:${\;}_{10}^{18}$O | D. | 苯的结构简式: |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 短周期元素Q、R、T、P在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、P在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com