
【题目】用电子式表示下列物质的结构:
(1)NH4Cl;
(2)Na2O2;
(3)CO2;
(4)MgCl2;(1)~(6)中,仅含离子键的是 , 仅含共价键的是 , 既有离子键又有共价键的是 .
【答案】
(1)![]()
(2)![]()
(3)![]()
(4)![]() ;(1)(2)(4);(3);(1)(2)
;(1)(2)(4);(3);(1)(2)
【解析】(1)氯化铵是离子化合物,由氨根离子与氯离子构成,铵根离子内部,氮原子与氢原子通过共价键结合,电子式为: ![]() ,故答案为:
,故答案为: ![]() ;(2)Na2O2是离子化合物,由Na+离子和O2﹣离子构成,过氧根离子内部两个氧原子共用一对电子,Na2O2的电子式为:
;(2)Na2O2是离子化合物,由Na+离子和O2﹣离子构成,过氧根离子内部两个氧原子共用一对电子,Na2O2的电子式为: ![]() ,故答案为:
,故答案为: ![]() ;(3)二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为:
;(3)二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为: ![]() ,故答案为:
,故答案为: ![]() ;(4)氯化镁是离子化合物,由镁离子与氯离子构成,电子式为
;(4)氯化镁是离子化合物,由镁离子与氯离子构成,电子式为 ![]() ,故答案为:
,故答案为: ![]() ;氯化铵含有离子键和共价键;过氧化钠含有离子键和共价键;二氧化碳只含共价键;氯化镁只含离子键;
;氯化铵含有离子键和共价键;过氧化钠含有离子键和共价键;二氧化碳只含共价键;氯化镁只含离子键;
所以:(1)~(6)中,仅含离子键的是(1)(2)(4),仅含共价键的是(3),既有离子键又有共价键的是(1)(2);
故答案为:(1)(2)(4);(3);(1)(2);
(1)氯化铵为离子晶体,由氨根离子与氯离子通过离子键结合在一起,铵根离子内部,氮原子与氢原子通过共价键结合,氯化铵含有离子键和共价键;(2)Na2O2是离子化合物,由Na+离子和O22﹣离子构成,过氧根离子内部两个氧原子共用一对电子,过氧化钠含有离子键和共价键;(3)二氧化碳中存在两对碳氧共用电子对,二氧化碳只含共价键;(4)氯化镁是离子化合物,由镁离子与氯离子构成,注意电子式中相同离子不能合并,氯化镁只含离子键;


科目:高中化学 来源: 题型:
【题目】Ⅰ.用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。若需配制浓度为0.01000 mol·L-1的K2Cr2O7标准溶液250 mL,应准确称取________ g K2Cr2O7(保留4位有效数字,已知M(K2Cr2O7)=294.0 g·mol-1)。
配制该标准溶液时,下列仪器中不必要用到的有________(用编号表示)。
①电子天平 ②烧杯 ③量筒 ④玻璃棒 ⑤容量瓶 ⑥胶头滴管 ⑦移液管
Ⅱ.四氯化硅粗产品经精馏后,得到的残留物中常含有铁元素,为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO+8H+===5Fe3++Mn2++4H2O。
滴定前是否要滴加指示剂?________(填“是”或“否”),请说明理由__________________。
Ⅲ.某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用______作滴定指示剂,滴定终点的现象是_______________________________。
②CuCl2溶液与KI反应的离子方程式为________________________________________。
③碘与硫代硫酸钠反应的离子方程式是________________________________________。
④该试样中CuCl2·2H2O的质量百分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能表示阿伏加德罗常数值的是( )
A. 1 mol金属钠含有的电子数
B. 标准状况下,22.4 L苯所含的分子数
C. 0.012 kg 12 C所含的原子数
D. 1 L 1 mol·L-1硫酸溶液所含的H+数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种有机合成中间体,Z是常见的高分子化合物,某研究小组采用如下路线合成X和Z:
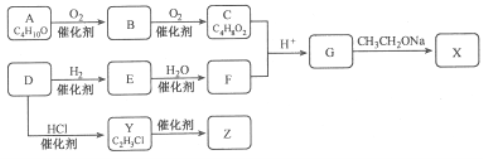
已知:①化合物A的结构中有2个甲基
②RCOOR′+R′′CH2COOR′![]()
![]()
请回答:(1)写出化合物E的结构简式__________,F中官能团的名称是_________。
(2)Y→Z的化学方程式是____________。
(3)G→X的化学方程式是__________,反应类型是___________。
(4)能与NaOH反应的G的同分异构体有_____种
(5)若C中混有B,请用化学方法检验B的存在(要求写出操作、现象和结论)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在容积为2L的密闭容器中,X、Y、Z三种气体物质的量随时间的变化曲线如图所示,根据图中数据,试回答:
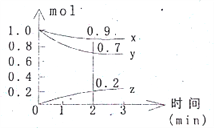
(1)计算反应开始2min内的v(x)=_________,v(y)=_________,v(z)=___________。
(2)容器内的反应物是______________。
(3)写出该反应的化学方程式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类合理的是( )
A. 铵盐:NH4Cl、NH4NO3、(NH4)2SO4、NH3·H2O
B. 碱:NaOH、KOH、Ba(OH)2、Na2CO3
C. 氧化物:CO2、NO、SO2、H2O
D. 碱性氧化物:Na2O、CaO、Mn2O7、Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)比较下列各组热化学方程式中△H的大小关系:
①S(s)+O2(g)═SO2(g)△H1
S(g)+O2(g)═SO2(g)△H2
△H1__________△H2(填><或“=”,下同);
②CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1
CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H2
△H1_______△H2;
③4Al(s)+3O2(g)═2Al2O3(s)△H1
4Fe(s)+3O2(g)═2Fe2O2(s)△H2
△H1_________△H2
(2)已知H2(g)+1/2O2(g)=2H2O(g),反应过程中能量变化如下图:请回答下列问题:

①图中a,b分别代表什么意义?
a.______________ ;b.__________。
②该反应是__________反应(填“吸热”或“放热”), △H ___________(填“< 0”或“> 0”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g) ![]() 2N2+3H2O(g) ΔH<0,在恒容的密闭容器中,下列有关说法正确的是 ( )
2N2+3H2O(g) ΔH<0,在恒容的密闭容器中,下列有关说法正确的是 ( )
A. 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B. 平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C. 单位时间内消耗NO和N2的物质的量比为1∶2时,反应达到平衡
D. 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com