
| A. | 含等物质的量的HNO3、Na2CO3、CH3COOH的溶液 | |
| B. | pH=1的盐酸与pH=13的氨水等体积混合 | |
| C. | 0.05mol/L的H2SO4和0.1mol/L的KOH等体积混合 | |
| D. | pH=2的CH3COOH和pH=12的NaOH等体积混合 |
分析 A.含等物质的量的HNO3、Na2CO3、CH3COOH的溶液混合,反应后溶质为硝酸钠、醋酸钠,结合盐的水解原理判断;
B.一水合氨为弱碱,混合液中氨水过量,溶液呈碱性;
C.两溶液恰好反应生成硫酸钾,溶液呈中性;
D.醋酸为弱碱,混合液中醋酸过量,溶液呈酸性.
解答 解:A.含等物质的量的HNO3、Na2CO3、CH3COOH的溶液中溶质为硝酸钠和醋酸钠,醋酸根离子水解,导致溶液呈碱性,溶液的pH大于7,故A正确;
B.pH=1的盐酸与pH=13的氨水等体积混合,由于一水合氨为弱碱,则混合液中氨水过量,溶液呈碱性,溶液的pH大于7,故B正确;
C.0.05mol/L的H2SO4中氢离子浓度为0.1mol/L,与0.1mol/L的KOH等体积混合后恰好反应生成硫酸钾,溶液呈中性,溶液的pH=7,故C错误;
D.pH=2的CH3COOH和pH=12的NaOH等体积混合,由于醋酸为弱酸,混合液中醋酸过量,溶液显示酸性,溶液的pH小于7,故D错误;
故选AB.
点评 本题考查了化学实验方案的评价,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,B、D为易错点,注意弱电解质在溶液中部分电离的特点,试题侧重考查学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题
| 碳 | 氮 | Y | |
| X | 硫 | Z |
 .Q与水反应的化学方程式为Mg2C3+4H2O=2Mg(OH)2+C3H4↑.
.Q与水反应的化学方程式为Mg2C3+4H2O=2Mg(OH)2+C3H4↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y元素形成的单核阴离子还原性强于X元素形成的单核阴离子还原性 | |
| B. | Z元素的简单气态氢化物的沸点比Y的氢化物沸点高 | |
| C. | W元素氧化物对应水化物的酸性一定强于Z元素氧化物对应水化物的酸性 | |
| D. | X的气态氢化物可与其最高价含氧酸反应生成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使元素的化合态转化成游离态的过程可能是还原的过程 | |
| B. | 高炉炼铁的原料有铁矿石、焦炭和空气.工业上就是用焦炭还原铁矿石以制得生铁 | |
| C. | 电解熔融氧化铝时,每还原出2.7kg铝,必有300mol电子转移 | |
| D. | 工业上常用电解熔融NaCl的方法制取金属钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
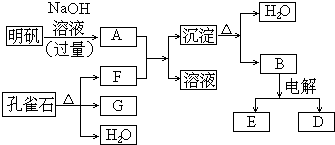
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 0 | 10 | 20 | 30 | 40 |
| c(H2O2) mol•L-1 | 0.80 | 0.40 | 0.20 | 0.10 | 0.05 |

查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 萃取操作必须在分液漏斗中进行 | |
| B. | 用剩的药品应收集起来放回原试剂瓶中 | |
| C. | 振荡试管中液体时,手拿住试管,用手腕甩动 | |
| D. | 称量物质时先取小砝码,再依次取较大的砝码 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com