
【题目】将久置在空气中的锌粒投人稀硫酸中,测得锌粒和硫酸反应产生氢气的速率v(H2)与反应时间t的关系曲线如图所示。下列推论不正确的是( )

A.O→a段由于是锌粒表面的氧化物与酸的反应,所以未产生气体
B.b→c段产生氢气的速率增大较快的主要原因是温度升高
C.c时刻反应生成的H2的量最多
D.c时刻之后产生氢气的速率减小的主要原因是溶液中c(H+ )减小
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 增加固体反应物的质量,反应速率一定加快
B. 镁与稀盐酸反应时,加入适量的氯化钾溶液,生成氢气的速率不变
C. 对于可逆反应,升高反应体系温度,正反应速率和逆反应速率均增加
D. A(g)+B(g)![]() C(g)+D(g),恒温恒容充入 He 以增大压强,化学反应速率加快
C(g)+D(g),恒温恒容充入 He 以增大压强,化学反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2A(g)+B(g)![]() 3C(g)+D(s)△H<0,在其他条件不变时,改变某一条件对上述反应的影响,下列分析不正确的是
3C(g)+D(s)△H<0,在其他条件不变时,改变某一条件对上述反应的影响,下列分析不正确的是

A. 图I表示增加反应物浓度对该平衡的影响
B. 图II表示减小压强对该平衡的影响
C. 图Ⅲ表示温度对该平衡的影响,温度:乙>甲
D. 图IV表示催化剂对该平衡的影响,催化效率:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列各组化合物中,化学键类型和化合物类型均相同的是_________(填序号)。
①CaCl2和 Na2S ②Na2O 和 Na2O2 ③CO2和CaO ④HCl 和 NaOH
(2)下列过程不一定释放能量的是________。
①化合反应;②分解反应;③形成化学键;④燃料燃烧;⑤酸碱中和;⑥炸药爆炸
(3)Ba(OH)2 8H2O和NH4Cl反应的化学方程式是________________________________,反应过程能量变化的图像符合_____________(填“图1”或“图2”)。
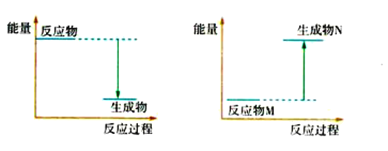
图1 图2
(4)已知1 mol石墨转化为1 mol金刚石要吸收能量,则石墨比金刚石_______(填“稳定”或“不稳定”)。
(5)一定量的氢气在氧气中充分燃烧并放出热量。若生成气态水放出的热量为Q1,生成液态水放出的热量为Q2,那么Q1______Q2(填大于、小于或等于)。
(6)已知:4HCl+O2=2Cl2+2H2O。该反应中,4 mol HCl被氧化,放出115.6 kJ的热量,且断开O=O键和Cl-Cl键所需的能量如下图所示。则断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为______ kJ。
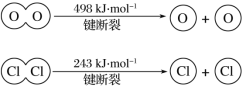
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据如图判断,下列说法正确的是( )

A. 氢气的燃烧热ΔH=-241.8 kJ·mol-1
B. 2 mol H2(g)与1mol O2(g)所具有的总能量比2 mol H2O(g)所具有的总能量低
C. 液态水分解的热化学方程式为2H2O(l)=2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
D. H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识,回答下列问题:
(1)在反应N2(g)+3H2(g) ![]() 2NH3(g)中,若以N2表示的该反应的化学反应速率为0.2 mol/(L·min),则以H2表示此反应的化学反应速率为 _____________ mol/(L·min)
2NH3(g)中,若以N2表示的该反应的化学反应速率为0.2 mol/(L·min),则以H2表示此反应的化学反应速率为 _____________ mol/(L·min)
(2)在5 L的恒容密闭容器中,充人0.1 mol N2和0.4 mol H2,在一定条件下发生反应,2s后测得N2的物质的量为0.09mol,则以NH3的浓度变化表示的反应速率为 ___________ mol/(L·s)
(3)将0.2 mol NH3充人容积为10 L的恒容密闭容器中,某温度下发生反应2NH3(g)![]() N2(g) + 3H2(g),在0~2s内,消耗NH3的平均速率为0.002 mol/(L·s),则在2s时,容器中生成_____________molH2,此时NH3的物质的量浓度为______________ mol/L。
N2(g) + 3H2(g),在0~2s内,消耗NH3的平均速率为0.002 mol/(L·s),则在2s时,容器中生成_____________molH2,此时NH3的物质的量浓度为______________ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是
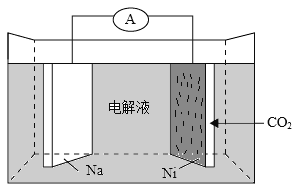
A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素T、X、Y、Z、W在元素周期表中的相对位置如下表所示,其中T的单质在一定条件下能与W的最高价氧化物对应水化物的浓溶液反应并生成两种酸性气体,则下列相关说法正确的是

A. 离子半径:X<Y<W
B. 最简单气态氢化物的热稳定性:W<Z
C. ![]() 分子中每个原子均满足8电子稳定结构
分子中每个原子均满足8电子稳定结构
D. 最高价氧化物对应水化物的碱性:X<Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com