
| A. | HCl和MgCl2 | B. | H2O和CO2 | C. | Ar和CCl4 | D. | NH4Cl和Na2O |
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,第IA族、第IIA族和第VIA族、第VIIA族元素之间易形成离子键,据此分析解答.
解答 解:A.HCl分子中H原子和Cl原子之间只存在共价键,MgCl2中镁离子和氯离子之间只存在离子键,所以化学键类型不同,故A错误;
B.H2O分子中H原子和O原子之间只存在共价键、CO2分子中C原子和O原子之间存在共价键,所以化学键类型相同,故B正确;
C.Ar为单原子分子,不含共价键,故C错误;
D.Na2O含离子化合物,NH4Cl含有离子键和共价键,所以化学键类型不同,故D错误.
故选B.
点评 本题考查化学键的判断,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,注意特殊物质中的化学键,题目难度不大.


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物稳定性:HF>HCl | B. | 碱性:NaOH>KOH | ||
| C. | 非金属性:P>Cl | D. | 酸性:H2SO4>HClO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(B2)=0.8mol(L•s)-1 | B. | v(A2)=0.4 mol(L•s)-1 | ||
| C. | v(C)=0.6 mol(L•s)-1 | D. | v(D)=0.1 mol(L•s)-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
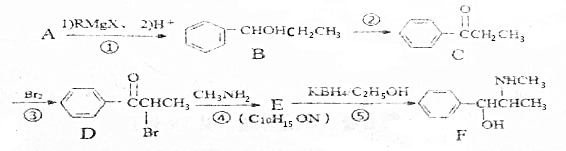
 (R、R′、R″均代表烃基;X代表卤素原子);
(R、R′、R″均代表烃基;X代表卤素原子); .
. .反应⑤的反应类型为还原反应.
.反应⑤的反应类型为还原反应. .
. (写反式结构)
(写反式结构)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
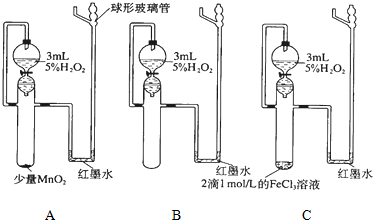
| 实验目的 | 催化剂对过氧化氢分解化学反应速率影响 | ||
| 实验步骤 | 在三个相同的带活塞的漏斗中分别加入2~3mL约5%的H2O2,然后在一支试管中滴加2滴1mol/L的FeCl3溶液,另一支试管中加入少量MnO2固体.同时向三支试管中放入漏斗中的全部溶液,观察红墨水上升情况. | ||
| 反应条件 | A少量MnO2 | B无催化剂 | C 2滴FeCl3溶液 |
| 实验现象 | |||
| 反应速 率大小 | (用v (A)、v (B)、v (C)表示) | ||
| 得出结论 | |||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol•L-1的硫酸溶液中,图为反应产生氢气速率与反应时间的关系图.
某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol•L-1的硫酸溶液中,图为反应产生氢气速率与反应时间的关系图.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验目的 | 操作 | 现象 |
| A | 比较酸性:HF>H2CO3 | 向盛有少量NaHCO3溶液的试管中滴加足量HF溶液 | 有无色气体产生 |
| B | 验证SO2的漂白性 | 将SO2通入石蕊溶液中 | 石蕊溶液褪色 |
| C | 比较非金属性:Br>I | 将溴水滴加到KI-淀粉溶液中 | 溶液变蓝 |
| D | 检验某溶液中是否含有SO42- | 向盛有少量待测液的试管中先滴加Ba(NO3)2溶液,再滴加稀盐酸 | 有白色沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com