
| A、将40g NaOH固体溶解于1L水中 |
| B、将22.4L氯化氢气体溶于水配成1L溶液 |
| C、将1L 10 mol/L浓盐酸与10L水混合 |
| D、10g NaOH固体溶解在水中配成250mL溶液 |


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:
| 元素代号 | L | M | Q | R | T | |
| 原子半径(10-10 m) | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | |
| 常见化合价 | 最高正价 | +2 | +3 | +6 | +2 | |
| 最低负价 | -2 | -2 | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶液组成主要成分 | 对应图象 | 溶液中离子浓度关系 | |
| A | NaHCO3 | 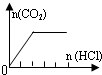 | c(Na+)=c(HCO3-) |
| B | NaHCO3、Na2CO3 | 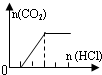 | c(CO32-)<c(HCO3-) |
| C | NaOH、Na2CO3 | 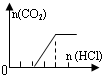 | c(OH-)>c(CO32-) |
| D | Na2CO3 | 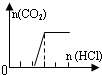 | c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、脱氧过程是吸热反应,可降低温度,延长糕点保质期 |
| B、含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况) |
| C、脱氧过程中铁作原电池负极,电极反应为:Fe-3e-=Fe3+ |
| D、脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4e-=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、B>A>D>C |
| B、A>B>D>C |
| C、B>A>C>D |
| D、C>D>A>B |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molSO2 (g)的能量总和大于1molS(s)和1mol O2(g)的能量总和 |
| B、1molSO2(g)的能量总和小于1molS(s)和1molO2(g)的能量总和 |
| C、S(g)+O2(g)=SO2(g)△H=-Q kJ/mol; Q的值大于297.23 |
| D、S(g)+O2(g)=SO2(g)△H=-Q kJ/mol; Q的值等于297.23 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、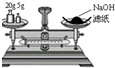 称量氢氧化钠固体 |
B、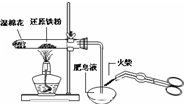 检验铁粉与水蒸气反应产生的氢气 |
C、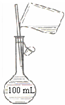 配制150 mL 0.10 mol/L盐酸 |
D、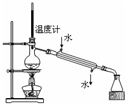 分离两种互溶但沸点相差较大的液体混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放热46.3kJ |
| ② | 0.8 | 2.4 | 0.4 | Q(Q>0) |
| A、容器①中达到平衡时,Y2的转化率为50% |
| B、Q=27.78kJ |
| C、若X2、Y2、XY3改按0、0、2投料,则达到平衡时吸热46.3KJ |
| D、若容器①体积改为1.0L.则达平衡时放出的热量小于46.3kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com