
 25℃时,部分物质的电离平衡常数如表所示:
25℃时,部分物质的电离平衡常数如表所示:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
分析 (1)电离平衡常数越大,酸的电离程度越大,溶液酸性越强;
(2)酸根离子对应酸的酸的电离平衡常数越大,则其结合氢离子能力越弱;
(3)CH3COOH溶液加水稀释过程中,醋酸的电离程度增大,氢离子浓度、醋酸根离子浓度减小,但氢氧根离子浓度增大;由于温度不变,则电离平衡常数、水的离子积不变;升高温度后醋酸的电离程度增大,则溶液中氢离子浓度增大、水的离子积增大、电离平衡常数增大;
(4)由图可知,稀释相同的倍数,HX的pH变化程度大,则酸性HX强,电离平衡常数大;稀释后,HX电离生成的c(H+)小,对水的电离抑制能力小.
解答 解:(1)根据表中数据可知,酸的电离出平衡常数大小为:CH3COOH>H2CO3>HCO3->HClO,电离平衡常数越大,酸性越强,所以酸性由强到弱的顺序为为:CH3COOH>H2CO3>HClO,
故答案为:CH3COOH>H2CO3>HClO;
(2)酸根离子对应酸的酸的电离平衡常数越大,则其结合氢离子能力越弱,由于电离平衡常数CH3COOH>H2CO3>HCO3->HClO,则同浓度CH3COO-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为:CO32->ClO->HCO3->CH3COO-,
故答案为:CO32->ClO->HCO3->CH3COO-;
(3)A.0.1mol•L-1的CH3COOH溶液加稀释过程中,溶液中氢离子浓度减小,故A正确;
B.0.1mol•L-1的CH3COOH溶液加稀释过程中,各个微粒浓度减小,同时醋酸的电离向右移动,c(H+)减小的程度小于c(CH3COOH)的减小程度,则$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$增大,故B错误;
C.Kw=c(H+)•c(OH-)只受温度的影响,温度不变则其值是一个常数,故C错误;
D.醋酸稀释,酸性减弱,c(H+)减小,水的离子积不变,则c(OH-)增大,所以$\frac{c(O{H}^{-})}{c({H}^{+})}$增大,故D错误;
E.$\frac{cC{H}_{3}CO{O}^{-}•c{H}^{+}}{cC{H}_{3}COOH}$为醋酸的电离平衡常数,由于温度不变,则水的电离平衡常数不变,故E错误;
故答案为:A;
若该溶液升高温度,醋酸、水的电离程度对增大,则溶液中氢离子、氢氧根离子浓度都增大,
A.升高温度后溶液中氢离子浓度c(H+)增大,故A正确;
B.升高温度后氢离子、氢氧根离子浓度都增大,醋酸的浓度减小,则$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的比值增大,故B正确;
C.c(H+)•c(OH-)为水的离子积,升高温度后水的电离程度增大,则水的离子积增大,故C正确;
D.升高温度后氢氧根离子、氢离子浓度都增大,但氢氧根离子浓度增大的幅度大于氢氧根离子,所以$\frac{c(O{H}^{-})}{c({H}^{+})}$的比值减小,故D错误;
E.$\frac{cC{H}_{3}CO{O}^{-}•c{H}^{+}}{cC{H}_{3}COOH}$为醋酸的电离平衡常数,升高温度后产生的电离平衡常数增大,故E正确;
故答案为:ABCE;
(4)根据图象分析知道,起始是两种溶液中c(H+)相同,c(较弱酸)>c(较强酸),稀释过程中较弱酸的电离程度增大,故在整个稀释过程中较弱酸的c(H+)一直大于较强酸的c(H+),稀释相同倍数,HX的pH变化比CH3COOH的大,故HX酸性强,电离平衡常数大;HX酸性强于CH3COOH的,稀释后HX溶液中c(H+)小于CH3COOH溶液中的c(H+),所以对水的抑制能力减弱,
故答案为:大于;稀释相同倍数,HX的pH变化比CH3COOH的大,酸性强,电离平衡常数大;大于;HX酸性强于CH3COOH的,稀释后HX溶液中的c(H+)小于CH3COOH溶液中的c(H+),所以其对水电离的抑制能力也较弱.
点评 本题考查了弱电解质的电离及其影响,题目难度中等,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用所学知识的能力,明确温度、浓度等对电离平衡常数、水的离子积的影响为解答关键.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;元素C在周期表中的位置是第二周期第VA族,A与B所形成的化合物BA4的电子式为
;元素C在周期表中的位置是第二周期第VA族,A与B所形成的化合物BA4的电子式为 ;
;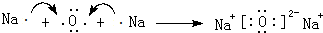 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝与氧气在常温下不反应 | |
| B. | 铝的化学性质不活泼 | |
| C. | 常温下与氧气反应,铝的表面形成了一层致密的氧化膜 | |
| D. | 铝制容器既耐酸又耐碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向磁性氧化铁溶解于足量稀盐酸后的溶液中滴加酸性KMnO4溶液,紫红色消失,表明溶液中含有Fe2+ | |
| B. | 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 | |
| C. | FeCl3、FeCl2、Fe(OH)3三种化合物都可以通过化合反应制得 | |
| D. | 向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一氧化碳的摩尔质量为28g | |
| B. | 0.5 mol OH-的质量为8.5g | |
| C. | 镁原子的摩尔质量等于它的相对原子质量 | |
| D. | 一个钠原子的质量等于$\frac{23}{6.02×1{0}^{23}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2溶液和NaOH溶液 | B. | 稀H2S04和Ba(OH)2溶液 | ||
| C. | AgNO3溶液和NaCl溶液 | D. | H20和CCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL 1mol/L的NaCl | B. | 75mL 3mol/L的NH4Cl | ||
| C. | 150mL 2mol/L的KCl | D. | 75mL 2mol/L的CaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3与FeO的物质的量之比为1:6 | |
| B. | 硝酸的物质的量浓度为3.0 mol/L | |
| C. | 产生的NO在标准状况下的体积为4.48 L | |
| D. | Fe2O3,FeO与硝酸反应后剩余HNO3为0.2 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com