
【题目】将30 mL 0.5 mol·L-1 NaOH溶液加水稀释到500 mL,关于稀释后的溶液叙述不正确的是( )
A. 浓度为0.03 mol·L-1 B. 从中取出10 mL溶液,其浓度为0.03 mol·L-1
C. 含NaOH 0.6 g D. 从中取出10 mL溶液,含NaOH 0.015 mol
科目:高中化学 来源: 题型:
【题目】N 是一种重要的元素,其单质及化合物在诸多领域中都有广泛的应用。
(1)基态N 原子的核外电子排布式是_____________;最高能级的电子云轮廓图形状为_____________;N原子的第一电离能比O原子的大,其原因是_________________________。
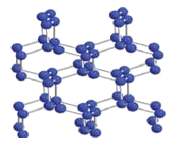
(2)在高压下氮气会发生聚合得到高聚氮,晶体结构如图所示。晶体中每个氮原子与另外三个氮原子结合形成空间网状结构。氮原子的杂化轨道类型为_________。这种高聚氮N-N 键的键能为160kJ/mol,而N2 的键能为942kJ/mol,其可能潜在的应用是______________________。
(3)南京理工大学团队成功合成了能在室温稳定存在的五氮阴离子盐(N5)6(H3O)3(NH4)4Cl,经X射线衍射测得晶体结构,其局部结构如图所示(其中N5-的立体结构是平面五元环)。下列说法正确的是________。
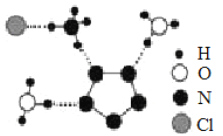
A.所有N 原子的价电子层均有孤对电子 B.两种阳离子均含有配位键
C.两种阳离子不是等电子体 D.阴阳离子之间只存在离子键
(4)NH3 与F2 反应生成NF3 和NH4F,这四种物质中,沸点由高到低的顺序是______;NF3中氮元素显_______价;属极性分子的有_________________。
(5)立方氮化硼称为超硬材料。晶胞结构如图所示:
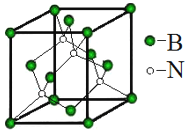
硼原子的配位数是__________。若晶胞参数为anm,则晶体的密度为____g·cm3 (用NA 表示阿伏伽德罗常数的值,列出代数式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提纯下列物质(括号内的物质为杂质),所选用的除杂试剂或分离方法不正确的是
选项 | 提纯的物质 | 除杂试剂 | 分离方法 |
A | 乙炔(硫化氢) | 硫酸铜溶液 | 洗气 |
B | 苯(苯酚) | 浓溴水 | 过滤 |
C | 乙醇(乙酸) | 生石灰 | 蒸馏 |
D | 苯甲酸(可溶性杂质) | 水 | 重结晶 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A. 向0.1mol/L CH3COOH溶液中加入少量水,溶液中c(H+)/c(CH3COOH)减小
B. 将CH3COONa溶液从20℃升温至30℃,溶液中c(CH3COO-)/[c(CH3COOH).c(OH-)]增大
C. 向盐酸中加入氨水至中性,溶液中[c(NH4+)/c(Cl-)]>1
D. 向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中c(Cl-)/c(Br-)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示细胞内某些有机物的元素组成和功能关系,其中A、B代表元素,Ⅰ、Ⅱ、Ⅲ、Ⅳ是生物大分子,图中X、Y、Z、P分别为构成生物大分子的基本单位。请回答下列问题:
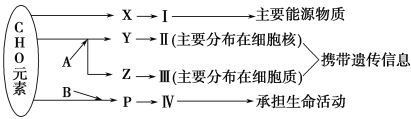
(1)图中X是________,Ⅰ在小麦种子中主要是指__________,在动物细胞是指_________。
(2)图中A是指________,Y为__________ ,由它合成的Ⅱ是__________。
(3)图中________是大肠杆菌的遗传物质,图中_______是HIV的遗传物质。
(4)图中P生成Ⅳ反应场所是________。
(5)构成细胞的化合物中,随着年龄增长会明显减少的主要是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是新一代饮用水的消毒剂,许多发达国家的自来水厂采用ClO2代替Cl2来进行自来水消毒。我国最近成功研究出制取ClO2的新方法,其反应的微观过程如下所示:

下列有关该反应的叙述中正确的是( )
A.该反应是复分解反应
B.该反应的化学方程式为Cl2+2NaClO2===2ClO2+2NaCl
C.反应中Cl2既是氧化剂,又是还原剂
D.NaClO2和ClO2中Cl的化合价相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用KMnO4和浓盐酸反应制取氯气。其变化可表述为:2KMnO4+16HCl(浓) ===2KCl+2MnCl2+5Cl2↑+8H2O。
(1)请将上述化学方程式改写为离子方程式________________。
(2)浓盐酸在反应中显示出来的性质是________________(填写编号)。
①只有还原性②还原性和酸性 ③只有氧化性④氧化性和酸性
(3)此反应中氧化产物是________(填化学式),产生0.5 mol Cl2,则转移的电子的物质的量为______mol。
(4)用双线桥法表示该反应的电子转移的方向和数目_______。
2KMnO4+16HCl(浓) ===2KCl+2MnCl2+5Cl2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】福酚美克是一种影响机体免疫力功能的药物,可通过以下方法合成:
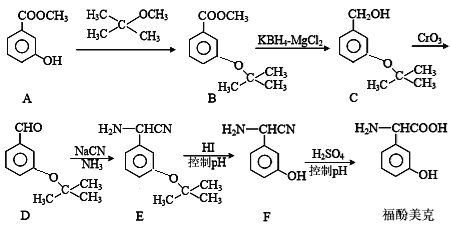
(1)物质A的名称是__________________________
(2)B→C的转化属于_______反应(填反应类型)。
(3)上述流程中设计A→B步骤的目的是_________________________________。
(4)A与足量氢氧化钠溶液反应的方程式为:_________________________________。
(5)A的同分异构体X满足下列条件:
Ⅰ.能与NaHCO3反应放出气体; Ⅱ.能与FeCl3溶液发生显色反应。
符合上述条件的同分异构体有______种。其中核磁共振氢谱有5组吸收峰的结构简式为_____________。
(6)参照上述合成路线和信息,以乙醛为原料(无机试剂任选),设计制
的合成路线:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2、CO、CO2、NOx是对环境影响较大的几种气体,对它们的合理控制和治理是优化我们生存环境的有效途径.

(1)利用电化学原理将CO、SO2转化为重要化工原料,装置如图1所示:
①若A为CO,B为H2,C为CH3OH,则通入CO的为_________极(填“正”或“负”)。
②若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为:___________________________。
(2)碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1∶1)直接做燃料,其工作原理如图2所示。
①电池总反应为____________________________________________。
②以此电源电解足量的硝酸银溶液,若阴极产物的质量为21.6g,电解后溶液体积为2L,溶液的pH约为___________。
(3)某研究小组利用下列装置用N2O4生产新型硝化剂N2O5。

①现以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2。在该电极上同时还引入CO2的目的是__________________________。
②电解过程中,生成N2O5的电极反应方程式为_________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com