
分析 原子序数小于36的X、Y、Z、W、J五种元素,原子序数依次增大,其中X是除碳元素外形成化合物种类最多的元素,则X为H元素;Y元素原子核外有三种不同的能级且各个能级所填充的电子数相同,则Y原子核外电子排布为1s22s22p2,Y为C元素;W元素原子最外层电子数是内层电子数的3倍,W有2个电子层,最外层电子数为6,故W为O元素;Z的原子序数介于碳元素与氧元素之间,故Z为N元素;J是第四周期中未成对电子数最多的元素,原子核外电子数排布为1s22s22p63s23p63d54s1,则J为Cr元素,据此解答.
解答 解:原子序数小于36的X、Y、Z、W、J五种元素,原子序数依次增大,其中X是除碳元素外形成化合物种类最多的元素,则X为H元素;Y元素原子核外有三种不同的能级且各个能级所填充的电子数相同,则Y原子核外电子排布为1s22s22p2,Y为C元素;W元素原子最外层电子数是内层电子数的3倍,W有2个电子层,最外层电子数为6,故W为O元素;Z的原子序数介于碳元素与氧元素之间,故Z为N元素;J是第四周期中未成对电子数最多的元素,原子核外电子数排布为1s22s22p63s23p63d54s1,则J为Cr元素.
(1)同周期自左而右第一电离能呈增大趋势,N元素原子的2p能级有3个电子,为半满稳定状态,能量较低,失去第一个电子需要的能量较高,第一电离能高于同周期相邻元素,故第一电离能C<O<N,
故答案为:C<O<N;
(2)J为原子的核外电子排布式为1s22s22p63s23p63d54s1,外围电子排布为3d54s1,故答案为:3d54s1;
(3)Y2X4分子为C2H4,结构式为 ,分子中C原子成2个C-H键、1个C=C键,杂化轨道数目为3,C原子轨道的杂化类型为sp2,单键是σ键,双键中含有1个σ键、1个π键,故分子中含有5个σ键、1个π键,1molC2H4分子中含有σ键与π键的数目之比为5:1,
,分子中C原子成2个C-H键、1个C=C键,杂化轨道数目为3,C原子轨道的杂化类型为sp2,单键是σ键,双键中含有1个σ键、1个π键,故分子中含有5个σ键、1个π键,1molC2H4分子中含有σ键与π键的数目之比为5:1,
故答案为:sp2;5:1;
(4)与H2O分子互为等电子体的阴离子为NH2-等,故答案为:NH2-;
(5)CrCl3能与NH3、H2O形成配位数为6的络合物,且相应两种配体的物质的量之比为2:1,1mol该配合物溶于水,加入足量的硝酸银溶液可得430.5g白色沉淀,AgCl物质的量为$\frac{430.5g}{143.5g/mol}$=3mol,氯离子全部位于外界,则该配合物的化学式为[Cr(NH3)4(H2O)2]Cl3,则该配合物溶于水的电离方程式为:[Cr(NH3)4(H2O)2]Cl3=[Cr(NH3)4(H2O)2]3++3Cl-,
故答案为:[Cr(NH3)4(H2O)2]Cl3=[Cr(NH3)4(H2O)2]3++3Cl-.
点评 本题是对物质结构与性质的考查,涉及核外电子排布规律、杂化轨道、等电子体、配合物等,难度中等,推断元素是解题的关键,注意配合物中内界与外界性质的不同.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为17、中子数为20的氯原子:${\;}_{17}^{20}$Cl | |
| B. | H2CO3的电离方程式:H2CO3?2H++CO32- | |
| C. | Na2O2的电子式: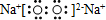 | |
| D. | 乙烯分子的结构简式:CH2CH2. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人造纤维、合成橡胶和光导纤维都属于有机高分子化合物 | |
| B. | 大力实施矿物燃料“脱硫、脱销技术”,减少硫的氧化物和氮的氧化物污染 | |
| C. | 用聚氯乙烯代替木材,生产包装盒、快餐盒等,以减少木材的使用 | |
| D. | 氢氧燃料电池、硅太阳能电池中都利用了原电池原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
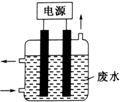 用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )| A. | ClO-将CN-氧化过程中,每消耗1molCN-转移10mol电子 | |
| B. | 阳极的电极反应式为:Cl-+2OH--2e-═ClO-+H2O | |
| C. | 阴极的电极反应式为:2H2O+2e-═H2↑+2OH- | |
| D. | 在电解过程中,废水中CN-和Cl-均移向阳极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2、3mol H2 | a mol CO2、b mol H2 c mol CH3OH(g)、c mol H2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铁溶于氢碘酸中:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O | |
| B. | 向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- | |
| C. | 向0.3mol/LNaClO溶液中滴加等体积的0.2mol/LNaHSO3溶液:2HSO3-+4ClO-═2SO42-+2Cl-+2HClO | |
| D. | 向碘化亚铁溶液中滴加溴的四氯化碳溶液2Br2+2Fe2++2I-═I2+4Br-+2Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙烯能使高锰酸钾酸性溶液变色 | |
| B. | 等物质的量的甲烷、乙炔完全燃烧,耗氧量甲烷大 | |
| C. | 葡萄糖、氨基酸在一定条件下都能发生酯化反应 | |
| D. | 分子式为C2H4、C3H6、C4H8的三种烃肯定是同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com