
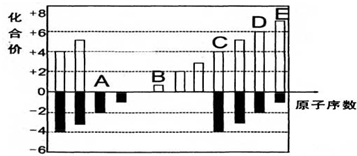
分析 A、B、C、D、E五种短周期元素,它们的原子序数依次增大.A为-2价,则A为O元素;B为+1价,则B为Na元素;C为+4价,则C为Si元素;D为+7价,则D为S元素;E为+7价,则E为Cl元素,据此解答.
解答 解:A、B、C、D、E五种短周期元素,它们的原子序数依次增大.A为-2价,则A为O元素;B为+1价,则B为Na元素;C为+4价,则C为Si元素;D为+7价,则D为S元素;E为+7价,则E为Cl元素.
(1)由上述分析可知:C为Si元素,处于元素周期表中第三周期第IVA族,Na元素的金属性最强,其第一电离能最小;Na的基态原子核外电子排布式为 1s22s22p63s1;故答案为:三;IVA;钠;1s22s22p63s1;
(2)非金属性:Cl>S,故高价氧化物的水化物中,酸性较强的是HClO4;O的电负性较强,能形成氢键,故H2O的沸点高于H2S,故答案为:HClO4;低;
(3)SiO2是原子晶体,SiO2是与NaOH反应生成硅酸钠和水,反应为SiO2+2OH-=SiO32-+H2O,故答案为:原子晶体;SiO2+2OH-=SiO32-+H2O;
(4)在298K、101.3kPa下,1.6gD单质在足量的氧气中燃烧,放出14.85kJ热量,则△H=-$\frac{14.85kJ}{\frac{1.6g}{32g/mol}}$=-297.0 kJ•mol-1;
故答案为:S(s)+O2(g)=SO2(g)△H=-297.0 kJ•mol-1.
点评 本题主要考查结构性质位置关系应用,难度不大,推断元素是解题关键,注意基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题
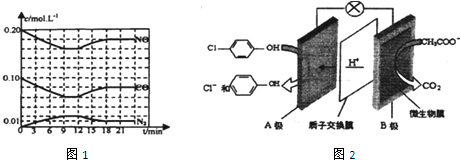
 )的酸性废水,可利用微生物电池法除去,其原理如图2所示
)的酸性废水,可利用微生物电池法除去,其原理如图2所示查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+K+OH-Cl- | B. | Na+Cu2+SO42-NO3- | ||
| C. | K+ Na+ SO42- Cl- | D. | Ba2+ CO32- NO3- K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 (不包括A)
(不包括A) ;反应类型是酯化反应(或取代反应).
;反应类型是酯化反应(或取代反应). .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH=1的溶液中还可以大量存在:K+、MnO4-、SO42-、CH3CHO | |
| B. | 含有较多Fe3+的溶液中还可以大量存在:Na+、SO42-、SCN-、CO32- | |
| C. | 碳酸氢钙溶液与过量的NaOH溶液反应:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| D. | 向FeBr2溶液中通入过量氯气:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,0.001 mol•L-1的醋酸中由水电离的c(H+)=10-11mol•L-1 | |
| B. | Na2CO3溶液中存在c(Na+)+c(H+)═c(OH-)+a c(X)+b c(Y),若X为HCO3-,则b=2 | |
| C. | 某温度下,浓度均为0.01mol•L-1的盐酸和氢氧化钠溶液的pH分别为2和12 | |
| D. | 向0.1mol•L-1氯化铵溶液滴加几滴浓盐酸,c(NH4+)减小,PH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
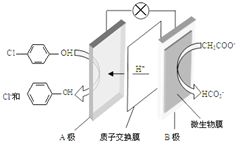 现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚(
现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚(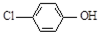 ),其原理如图所示,下列说法正确的是( )
),其原理如图所示,下列说法正确的是( )| A. | 当外电路中有0.2mole-转移时,通过质子交换膜的H+的个数为0.2NA | |
| B. | A极的电极反应式为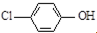 +e-═Cl-+ +e-═Cl-+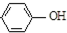 | |
| C. | 电流方向从B极沿导线经小灯泡流向A极 | |
| D. | B为电池的正极,发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 利用如图装置可以制取某些气体,所用药品合理且收集气体方法正确的是( )
利用如图装置可以制取某些气体,所用药品合理且收集气体方法正确的是( )| 制取气体 | 实验药品 | 收集气体方法 | |
| A | 二氧化碳 | 碳酸钙、稀硫酸 | 排饱和碳酸氢钠溶液 |
| B | 氧气 | 双氧水、二氧化锰 | 排水法 |
| C | 氨气 | 氧氡化钠溶液、浓氨水 | 向下排空气法 |
| D | 乙烯 | 氯乙烷,氢氧化钠、乙醇 | 排水法 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com