
| A. | Si与SiO2在常温下都可与NaOH溶液反应 | |
| B. | C与SiO2之间可以反应制备Si,同时得到CO | |
| C. | Si与SiO2都可以与氢氟酸反应 | |
| D. | Si→SiO2→H2SiO3可以通过一步反应实现 |
分析 A、硅与氢氧化钠反应生成硅酸钠与氢气、二氧化硅与氢氧化钠反应生成硅酸钠与水;
B、C与SiO2在高温下反应生成硅与一氧化碳;
C、Si与氢氟酸反应生成四氟化硅和氢气,SiO2能与氢氟酸反应SiO2+4HF═SiF4↑+2H2O;
D、二氧化硅不溶于水也不与水反应.
解答 解:A、硅与氢氧化钠反应生成硅酸钠与氢气、二氧化硅与氢氧化钠反应生成硅酸钠与水,所以Si与SiO2在常温下都可与NaOH溶液反应,故A正确;
B、C与SiO2在高温下反应生成硅与一氧化碳,所以可用C与SiO2之间可以反应制备Si,故B正确;
C、Si与氢氟酸反应生成四氟化硅和氢气,SiO2能与氢氟酸反应SiO2+4HF═SiF4↑+2H2O,所以Si与SiO2都可以与氢氟酸反应,故C正确;
D、二氧化硅不溶于水也不与水反应,不能通过一步反应实现,而是二氧化硅先与强碱反应生成硅酸盐,然后与酸反应生成硅酸,故D错误;
故选D.
点评 本题考查酸性氧化物SiO2的性质,注意酸性氧化物能与碱、碱性氧化物等发生反应是解答的关键.注意掌握二氧化硅的化学性质.题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1molCl2常温下与过量NaOH溶液反应转移电子总数为 0.1NA | |
| B. | 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| C. | 0.25 mol Na2O2中含有的阴离子数为0.5 NA | |
| D. | 1L 0.1mol•L-1的硫化钠溶液中硫离子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)甲醇(CH3OH)是一种重要的化工原料.已知 CH3OH(1)+O2(g)=CO(g)+2H2O(g);△H=-443.64kJ•mol-1
(1)甲醇(CH3OH)是一种重要的化工原料.已知 CH3OH(1)+O2(g)=CO(g)+2H2O(g);△H=-443.64kJ•mol-1 2B+C.
2B+C.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
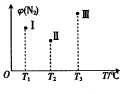 分别在Tl℃、T2℃、T3℃时,向三个500mL 的恒容密闭容器中均充人1molN2和2.5molH2,发生反应:N2(g)+3H2(g)?2NH3(g)△H<0.实验测得反应tmin 时N2的体积分数如图所示.下列说法正确的是( )
分别在Tl℃、T2℃、T3℃时,向三个500mL 的恒容密闭容器中均充人1molN2和2.5molH2,发生反应:N2(g)+3H2(g)?2NH3(g)△H<0.实验测得反应tmin 时N2的体积分数如图所示.下列说法正确的是( )| A. | 在t min时,Ⅱ和Ⅲ一定达平衡状态 | |
| B. | 2v(NH3)=3v(H2)时,三个容器均达平衡状态 | |
| C. | 平衡后容器Ⅰ中混合气体的平均相对分子质量最小 | |
| D. | 已知tmin时,Ⅲ中c(N2)=1mol/L,此时反应平衡常数K=0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
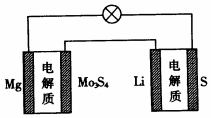 已知:镁电池的总反应为xMg+Mo3S4$?_{放电}^{充电}$MgxMo3S4,锂硫电池的总反应为2Li+S$?_{放电}^{充电}$Li2S.下列说法正确的是( )
已知:镁电池的总反应为xMg+Mo3S4$?_{放电}^{充电}$MgxMo3S4,锂硫电池的总反应为2Li+S$?_{放电}^{充电}$Li2S.下列说法正确的是( )| A. | 镁电池放电时,Mg2+向负极迁移 | |
| B. | 镁电池放电时,正极发生的电极反应为Mo3S4+2xe-=Mo3S42- | |
| C. | 理论上两种电池的比能量相同(参与电极反应的单位质量的电极材料放出电能的大小称为该电池的比能量) | |
| D. | 图中Li作负极,Mo3S4作阳极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com