
废旧硬质合金刀具中含碳化钨(WC)、金属钴(Co)及 少量杂质铁,利用电解法可回收WC和Co。工艺流程简图如下:
少量杂质铁,利用电解法可回收WC和Co。工艺流程简图如下:
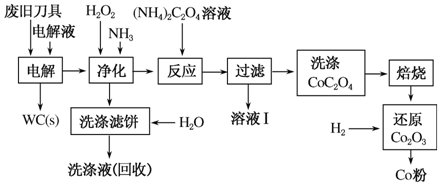
(1)电解时废旧刀具作阳极,不锈钢作阴极,HCl溶液为电解液。阴极主要的电极反应式为________。
(2)净化步骤所得滤饼的主要成分是________。回收的洗涤液代替水配制电解液,目的是回收利用其中的________。
(3)溶液Ⅰ的主要成分是________。洗涤CoC2O4不充分对最终产品纯度并无明显影响,但焙烧时会造成环境污染,原因是______________。
(4)将Co2O3还原成Co粉的化学反应方程式为________________。
解析 (1)阴极发生还原反应,应是H+放电生成氢气。(2)将 废旧刀具电解时阳极产生Co2+和Fe2+,加入双氧水后Fe2
废旧刀具电解时阳极产生Co2+和Fe2+,加入双氧水后Fe2 +被氧化生成Fe3+,通入氨气后生成Fe(OH)3沉淀,即滤饼的主要成分是Fe(OH)3。洗涤液中含有Co3+,可循环使用。(3)加入的草酸铵与CoCl2反应,生成草酸钴和氯化铵,则溶液Ⅰ中主要含有NH4Cl。若草酸钴表面的NH4Cl未洗净,则焙烧时NH4Cl分解产生NH3和HCl,造成环境污染。(4)Co2O3~6e-~2Co,H2~2e-~H2O,根据得失电子守恒有Co2O3~3H2,可得Co2O3+3H2===2Co+3H2O。
+被氧化生成Fe3+,通入氨气后生成Fe(OH)3沉淀,即滤饼的主要成分是Fe(OH)3。洗涤液中含有Co3+,可循环使用。(3)加入的草酸铵与CoCl2反应,生成草酸钴和氯化铵,则溶液Ⅰ中主要含有NH4Cl。若草酸钴表面的NH4Cl未洗净,则焙烧时NH4Cl分解产生NH3和HCl,造成环境污染。(4)Co2O3~6e-~2Co,H2~2e-~H2O,根据得失电子守恒有Co2O3~3H2,可得Co2O3+3H2===2Co+3H2O。
答案 (1)2H++2e-===H2
(2)Fe(OH)3 Co3+(或Co)
(3)NH4Cl 焙烧时NH4Cl分解产生NH3和HCl
(4)Co2O3+3H2===2Co+3H2O


 作业辅导系列答案
作业辅导系列答案科目:高中化学 来源: 题型:
欲用98%的浓硫酸(p=1.84g·cm-3 )配制成浓度为0.5mol·L-1的稀硫酸500ml。
(1) 选用的主要仪器有:
①__________,②__________,③__________,④____________,⑤____________。
(2) 请将下列各操作,按正确的序号填在横线上。
A.用量筒量取浓H2SO4 B.反复颠倒摇匀
C.用胶头滴管加蒸馏水至刻度线 D.洗净所用仪器
E.稀释浓H2SO4 F.将溶液转入容量瓶
其操作正确的顺序依次为__________ __________________。
(3)简要回答下列问题:
①所需浓硫酸的体积为____________mL。
(4)转移、洗涤。在转移时应使用________引流,需要洗涤烧杯2~3次是为了______________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用CH4催化还原NOx可以消除氮氧化物的污染。已知CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1,CH4(g)+4NO(g)===2N2 (g)+CO2(g)+2H2O(g)
(g)+CO2(g)+2H2O(g)
ΔH=-1 160 kJ·mol-1。若在标准状况下4.48 L CH4恰好能将一定量NO2还原成N2和H2O(g),则整个过程中放出的热量为( )
A.114.8 kJ B.232 kJ
C.368.8 kJ D.173.4 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回 答相关问题:
答相关问题:
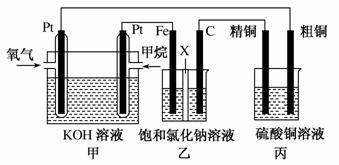
(1)甲烷燃料电池负极反应式是______________________ __________________________________________________。
(2)石墨(C)极的电极反应式为________________ __________________________。
(3)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁极上生成的气体体积为________L;丙装置中阴极析出铜的质量为________g。
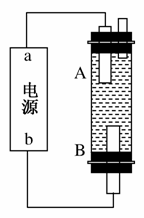
(4)某同学利用甲烷燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图所示)。
若用于制漂白液,a为电池的____极,电解质溶液最好用______。
若用于制Fe(OH)2,使用硫酸钠作电解质溶液,阳极选用________作电极。
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。在基态Ti2+中,电子占据的最高能层符号为________,该能层具有的原子轨道数为________。
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H22NH3实现储氢和输氢。下列说法正确的是________。
a.NH3分子中氮原子的轨道杂化方式为sp2杂化
b.NH 与PH
与PH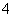 、CH4
、CH4 、BH
、BH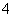 、ClO
、ClO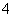 互为等电子体
互为等电子体
c.相同压强下,NH3沸点比PH3的沸点 高
高
d.[Cu(NH3)4]2+中,N原子是配位原子
(3)已知NF3与NH3的空间构型相同,但NF3不易与Cu2+形成配离子,其原因是________________________________________。
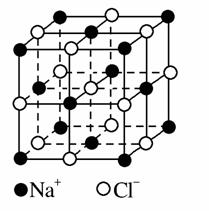
Ⅱ.氯化钠是生活中的常用调味品,也是结构化学中研究离子晶体时常用的代 表物,其晶胞结构如图所示。
表物,其晶胞结构如图所示。
(1)设氯化钠晶体中Na+与跟它最近邻的Cl-之间的距离为r,则与Na+次近邻的Cl-个数为________,该Na+与跟它次近邻的Cl-之间的距离为________。
(2)已知在氯化钠晶体中Na+的半径为a pm,Cl-的半径为b pm,它们在晶体中是紧密接触的,则在氯化钠晶体中离子的空间利用率为________。(用含a、b的式子
表示)
(3)纳米材料的表面原子占总原子数的比例很大,这是它有许多特殊性质的原因。假设某氯化钠颗粒形状为立方体,边长为氯化钠晶胞的10倍,则该氯化钠颗粒中表面原子占总原子数的百分比为___ _。
查看答案和解析>>
科目:高中化学 来源: 题型:
现取m g镁铝合金在一定浓度的稀硝酸中恰好完全溶解(硝酸的还原产物只有NO),向反应后的混合溶液中滴加b mol/L NaOH溶液,当滴加到V mL时,得到沉淀质量恰好为最大值n g,则下列有关该实验的说法中正确的有( )
①沉淀中OH-的质量为(n-m)g
②恰好溶解后溶液中的NO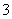 的物质的量为
的物质的量为 mol
mol
③反应过程中转移的电子数为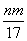 mol
mol
④标准状况下生成NO的体积为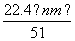 L
L
⑤与合金反应的硝酸的物质的量为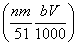 mol
mol
A.5项 B.4项
C.3项 D.2项
查看答案和解析>>
科目:高中化学 来源: 题型:
高锰酸钾(KMnO4)和过氧化氢(H2O2)是两种典型的氧化剂。
(1)H2O2的结构式为________________。
(2)下列物质中能使酸性KMnO4溶液褪色的是________(填序号)。
A.臭碱(Na2S) B.小苏打(NaHCO3)
C.水玻璃(Na2SiO3) D.酒精(C2H5OH)
(3)高锰酸钾、双氧水、活性炭常用于饮用水的处理,但三者联合作用时必须有先后顺序。
①在稀硫酸中,KMnO4和H2O2能发生氧化还原反应:
氧化反应:H2O2-2e-—→2H++O2↑
还原反应:MnO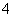 +5e-+8H+—→Mn2++4H2O
+5e-+8H+—→Mn2++4H2O
写出该氧化还原反应的离子方程式:____________________________。
②在处理饮用水时,活性炭应在高锰酸钾反应结束后投加,否则会发生反应:KMnO4+C+H2O—→MnO2+X+K2CO3(未配平),其中X的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有乙酸和两种链状单烯烃(分子中含一个碳碳双键)的混合物,若其中氧的质量分数为a,则碳的质量分数是( )
A.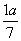 B.
B.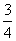 a
a
C.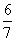 (1-a) D.
(1-a) D.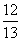 (1-a)
(1-a)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列除杂方法正确的是 ( )
A.除去乙烷中少量的乙烯:通入H2,加催化剂反应
B.除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液
C.除去NaBr溶液中的NaI:用氯水氧化NaI,再用CCl4萃取分液
D.除去乙醇中少量的乙酸:加足量生石灰,蒸馏
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com