
 ,写出D2A2、C2A电子式,D2A2:
,写出D2A2、C2A电子式,D2A2: ,C2A:
,C2A: .
.分析 A、B、C、D、E五种短周期元素,核电荷数按C、A、B、D、E的顺序增大.E的M层电子数是K层电子数的2倍,M层电子数为4,则E为Si;C、D都能分别与A按原子个数比为1:1或2:1形成化合物,CB可与EA2反应生成C2A和气态物质EB4,则C为H元素,A为O元素,D为Na元素,CB可与EA2反应生成C2A和气态物质EB4的反应为4:HF+SiO2═2H2O+SiF4↑,则B为F元素,据此解答.
解答 解:A、B、C、D、E五种短周期元素,核电荷数按C、A、B、D、E的顺序增大.E的M层电子数是K层电子数的2倍,M层电子数为4,则E为Si;C、D都能分别与A按原子个数比为1:1或2:1形成化合物,CB可与EA2反应生成C2A和气态物质EB4,则C为H元素,A为O元素,D为Na元素,CB可与EA2反应生成C2A和气态物质EB4的反应为4:HF+SiO2═2H2O+SiF4↑,则B为F元素.
(1)由上述分析可知,A为氧元素、B为氟元素、C为氢元素、D为钠元素、E为硅,
故答案为:氧;氟;氢;钠;硅;
(2)E为Si元素,质子数为14,最外层电子数为4,原子结构示意图为 ;D2A2为Na2O2,由钠离子与过氧根离子构成,电子式为
;D2A2为Na2O2,由钠离子与过氧根离子构成,电子式为 ;C2A为H2O,电子式为
;C2A为H2O,电子式为 ,
,
故答案为: ;
; ;
; ;
;
(3)EA2是SiO2,EB4是SiF4,SiO2为原子晶体,熔沸点较高,SiF4为分子晶体,熔沸点较低,沸点SiO2>SiF4.
故答案为:SiO2;SiF4.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意对基础知识的理解掌握.


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:选择题
| A. | 完全反应后所得溶液具有漂白性 | B. | 只发生了氧化还原反应 | ||
| C. | 会产生有刺激性气味的气体SO2 | D. | 溶液中存在HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F为原子序数依次增大的短周期元素,G为第四周期元素,B、C相邻且同周期,A、D同主族.A、C能形成两种化合物甲和乙,原子个数比分别为2:1和1:1,甲为常见的溶剂.E是地壳中含量最多的金属元素.F元素为同周期电负性最大的元素.D和F可形成化合物丙,E和F可形成化合物丁.G为第四周期未成对电子数最多的元素.请回答下列问题:
A、B、C、D、E、F为原子序数依次增大的短周期元素,G为第四周期元素,B、C相邻且同周期,A、D同主族.A、C能形成两种化合物甲和乙,原子个数比分别为2:1和1:1,甲为常见的溶剂.E是地壳中含量最多的金属元素.F元素为同周期电负性最大的元素.D和F可形成化合物丙,E和F可形成化合物丁.G为第四周期未成对电子数最多的元素.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,其分子内存在极性、非极性键.
,其分子内存在极性、非极性键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 图表归纳是学习化学的一种常用方法,某同学归纳的下表内容与如图对应正确的是( )
图表归纳是学习化学的一种常用方法,某同学归纳的下表内容与如图对应正确的是( )| 选项 | x | y | z |
| A | 胶体 | 混合物 | 淀粉溶液 |
| B | 化合物 | 酸性氧化物 | 二氧化氮 |
| C | 纯净物 | 化合物 | HD |
| D | 强电解质 | 强酸 | HI |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:(1)已知:N2(g)+3H2(g)?2NH3(g),如图是N2和H2反应生成2molNH3过程中能量变化示意图,请计算每生成1molNH3放出热量Q为46.1KJ;在该条件下向一密闭容器中充入0.5molN2和1.5mol H2,充分反应后,放出的热量<(填“<”、“>”或“=”)QkJ,理由是因为该反应是可逆反应,反应物不能完全转化.
氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:(1)已知:N2(g)+3H2(g)?2NH3(g),如图是N2和H2反应生成2molNH3过程中能量变化示意图,请计算每生成1molNH3放出热量Q为46.1KJ;在该条件下向一密闭容器中充入0.5molN2和1.5mol H2,充分反应后,放出的热量<(填“<”、“>”或“=”)QkJ,理由是因为该反应是可逆反应,反应物不能完全转化.| 实验组 | 温度/℃ | 起始量/mol | 2分钟/mol | |
| H2 | N2 | NH3 | ||
| 1 | 298 | 6 | 2 | 1.2 |
| 2 | 398 | 3 | 1 | 0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
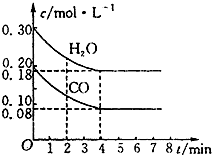 在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.CO和H2O的浓度变化如图所示(850℃时物质浓度的变化),则0~4min的平均反应速率v(CO)=0.03mol•L-1•min-1.
在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.CO和H2O的浓度变化如图所示(850℃时物质浓度的变化),则0~4min的平均反应速率v(CO)=0.03mol•L-1•min-1.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com