
【题目】某种信息素的结构简式为CH3(CH2)5CH=CH(CH2)9CHO,为验证该物质既含有醛基又含有碳碳双键,某同学设计了如下几种方案并对可能产生的现象进行了预测。
a.向该物质中加入溴水,观察到溴水褪色,然后再加入银氨溶液并水浴加热,观察到有银镜形成
b.向该物质中加入银氨溶液并水浴加热,观察到有银镜形成,然后再加入溴水,观察到溴水褪色
c.向该物质中滴加溴的CCl4溶液,观察到溶液褪色,然后再加入银氨溶液并水浴加热,观察有银镜形成
(1)你认为上述方案中行不通的是_____(填序号),理由是_________________________。
(2)分别写出溴的CCl4溶液、银氨溶液与该有机物反应的化学方程式:________、__________。
【答案】a、b 方案a中溴水能氧化醛基,方案b中溴水能与碱性溶液反应 CH3(CH2)5CH=CH(CH2)9CHO+Br2![]() CH3(CH2)5CHBrCHBr(CH2)9CHO CH3(CH2)5CH=CH(CH2)9CHO+2Ag(NH3)2OH
CH3(CH2)5CHBrCHBr(CH2)9CHO CH3(CH2)5CH=CH(CH2)9CHO+2Ag(NH3)2OH![]() CH3(CH2)5CH=CH(CH2)9COONH4+2Ag↓+3NH3 +H2O
CH3(CH2)5CH=CH(CH2)9COONH4+2Ag↓+3NH3 +H2O
【解析】
(1)由结构简式为CH3(CH2)5CH=CH(CH2)9CHO知既含有C=C 双键,又含有醛基。a.向该物质中加入溴水,因为C=C 双键和醛基都能使溴水褪色,所以a的方案是不正确的;b.向该物质中加入银氨溶液并水浴加热,观察到有银镜形成,说明含有醛基,因为此时溶液显碱性,碱能与溴水反应,所以观察到溴水褪色不能说明含有C=C双键,故b的方案是不正确的; c.向该物质中滴加溴的CCl4溶液,因为醛基不会和溴的CCl4溶液反应,所以观察到溶液褪色,说明含有C=C双键;然后再加入银氨溶液并水浴加热,观察有银镜形成,说明含有醛基,故c 的方案是正确的;答案:a、b ;方案a中溴水能氧化醛基,方案b中溴水能与碱性溶液反应。
(2)溴的CCl4溶液与该有机物反应的化学方程式: CH3(CH2)5CH=CH(CH2)9CHO+Br2![]() CH3(CH2)5CHBrCHBr(CH2)9CHO;银氨溶液与该有机物反应的化学方程式: CH3(CH2)5CH=CH(CH2)9CHO+2Ag(NH3)2OH
CH3(CH2)5CHBrCHBr(CH2)9CHO;银氨溶液与该有机物反应的化学方程式: CH3(CH2)5CH=CH(CH2)9CHO+2Ag(NH3)2OH![]() CH3(CH2)5CH=CH(CH2)9COONH4+2Ag↓+3NH3 +H2O。答案:CH3(CH2)5CH=CH(CH2)9CHO+Br2
CH3(CH2)5CH=CH(CH2)9COONH4+2Ag↓+3NH3 +H2O。答案:CH3(CH2)5CH=CH(CH2)9CHO+Br2![]() CH3(CH2)5CHBrCHBr(CH2)9CHO (4). CH3(CH2)5CH=CH(CH2)9CHO+2Ag(NH3)2OH
CH3(CH2)5CHBrCHBr(CH2)9CHO (4). CH3(CH2)5CH=CH(CH2)9CHO+2Ag(NH3)2OH![]() CH3(CH2)5CH=CH(CH2)9COONH4+2Ag↓+3NH3 +H2O。
CH3(CH2)5CH=CH(CH2)9COONH4+2Ag↓+3NH3 +H2O。


 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】二氧化碳用不同催化剂催化生成一氧化碳的历程中能量的转变如图所示,(吸附在催化剂表面的用“·”表示)下列说法错误的是( )
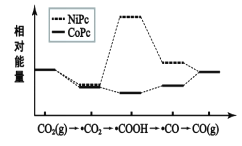
A.使用催化剂NiPc需要的条件更高
B.·COOH经过还原反应得到CO
C.反应过程中存在极性键的断裂和生成
D.相同微粒吸附在不同的催化剂时能量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种钠空气水电池的充、放电过程原理示意图如图所示,下列有关说法错误的是
■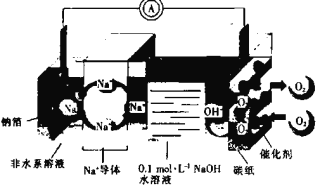
A.放电时,Na+向正极移动
B.放电时,电子由钠箔经过导线流向碳纸
C.充电时,当有0.1mole-通过导线时,则钠箔增重2.3g
D.充电时,碳纸与电源负极相连,电极反应式为4OH--4e=2H2O+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示。下列关于该有机物的说法正确的是( )
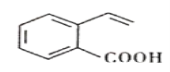
A.该有机物能发生酯化、加成、氧化、水解等反应
B.该有机物中所有碳原子不可能处于同一平面上
C.与该有机物具有相同官能团的同分异构体有3种
D.1mol该有机物最多与4molH2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境问题是广大群众关注的热点话题之一,化工厂排放的废水、废渣一般利用化学原理可以进行排放物达标检测与无害化处理。某皮革厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下:
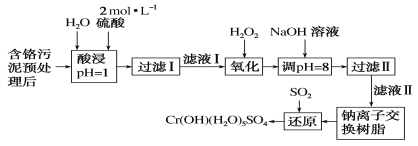
已知:①酸浸后的溶液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
沉淀完全时的pH | 3.7 | 11.1 | 5.4 | 9 |
沉淀溶解时的pH | — | — | >8溶解 | >9溶解 |
(1)如需配制480 mL酸浸环节所需的硫酸,需要用量筒量取18.4 mol·L-1的浓硫酸____mL;配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需哪些仪器_____。
(2)经氧化环节滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:________。
(3)调pH=8环节,既可以将溶液中某些杂质离子转化为沉淀,同时又可以将Cr2O72-转化为某种含铬元素微粒,溶液颜色由橙色变为黄色,请解释该颜色变化的原因_______。
(4)钠离子交换树脂的反应原理为Mn++nNaRMRn+nNa+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有________。
(5)请写出流程中用SO2进行还原时发生反应的离子方程式:______________。
(6)沉淀滴定法是测定粒子浓度的方法之一,为了测定某废水中SCN-的浓度,可用标准AgNO3溶液滴定待测液,已知:
银盐性质 | AgCl | AgI | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 黄 | 白 | 砖红 | 白 |
Ksp | 1.8×10-10 | 8.3×10-17 | 1.2×10-16 | 3.5×10-11 | 1.0×10-12 |
①滴定时可选为滴定指示剂的是________(填编号),
A.NaCl B.K2CrO4 C.KI D.NaCN
②如何确定该滴定过程的终点:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用碳和水蒸气制备水煤气的核心反应为:C(s)+H2O(g)H2(g)+CO(g)
(1)已知碳(石墨)、H2、CO的燃烧热分别为393.5kJ·mol-1、285.8kJ·mol-1、283kJ·mol-1,又知H2O(l)=H2O(g) ΔH=+44kJ·mol-1,则C(s)+H2O(g)CO(g)+H2(g) ΔH=___。
(2)在某温度下,在体积为1L的恒容密闭刚性容器中加入足量活性炭,并充入1mol H2O(g)发生上述反应,反应时间与容器内气体总压强的数据如表:
时间/min | 0 | 10 | 20 | 30 | 40 |
总压强/100kPa | 1.0 | 1.2 | 1.3 | 1.4 | 1.4 |
①平衡时,容器中气体总物质的量为________mol,H2O的转化率为________。
②该温度下反应的平衡分压常数Kp=________kPa(结果保留2位有效数字)。
(3)保持25℃、体积恒定的1L容器中投入足量活性炭和相关气体,发生可逆反应C+H2O(g)CO+H2并已建立平衡,在40 min时再充入一定量H2,50min时再次达到平衡,反应过程中各物质的浓度随时间变化如图所示:
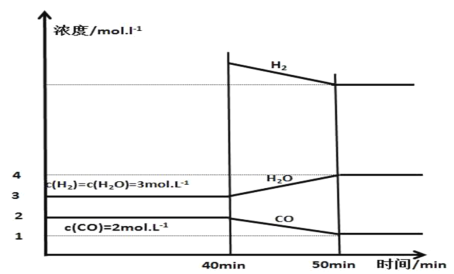
①40min时,再充入的H2的物质的量为________mol。
②40~50 min内H2的平均反应速率为________mol·L-1·min-1。
(4)新型的钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其原理如图所示:
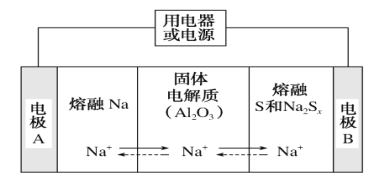
①放电时,电极A为________极,S发生________反应(填“氧化”或“还原”)。
②充电时,总反应为Na2Sx=2Na+Sx(3<x<5),Na所在电极与直流电源________极相连,阳极的电极反应式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有如图所示的装置,当电流表中产生持续电流时,下列说法正确的是( )
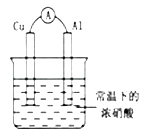
A.Cu是原电池的负极
B.Al是原电池的负极
C.电子由Al沿导线流向铜
D.铝片上的电极反应式为:Al﹣3e﹣═AL3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产中常用MnS作为沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)![]() CuS(s)+Mn2+(aq),下列说法正确的是
CuS(s)+Mn2+(aq),下列说法正确的是
A.该反应达到平衡时,c(Mn2+)=c(Cu2+)
B.该反应达到平衡时,Ksp(CuS)较大
C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)减小
D.该反应的平衡常数K=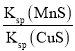
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列转化过程分析不正确的是
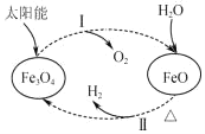
A.Fe3O4 中 Fe 元素的化合价为+2、+3
B.过程Ⅰ中每消耗 58 g Fe3O4 转移 1 mol 电子
C.过程Ⅱ的化学方程式为 3FeO+H2O![]() Fe3O4+H2↑
Fe3O4+H2↑
D.该过程总反应为 2H2O═2H2↑+O2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com