
| A. | 1 mol•L-1NaCl溶液含有NA个Na+ | |
| B. | 1 L 0.1 mol•L-1氨水含有0.1 NA个OH- | |
| C. | 电解饱和食盐水若产生2 g氢气,则转移2 NA个电子 | |
| D. | 将0.1 mol氯化铝溶于1 L水中,所得溶液含有0.1 NA个Al3+ |
分析 A、溶液体积不明确;
B、一水合氨为弱电解质;
C、求出氢气的物质的量,然后根据生成1mol氢气转移2mol电子来分析;
D、铝离子是弱碱阳离子,在溶液中会水解.
解答 解:A、溶液体积不明确,故溶液中的钠离子的个数无法计算,故A错误;
B、一水合氨为弱电解质,在溶液中不能完全水解,故溶液中的氢氧根的个数小于0.1NA个,故B错误;
C、2g氢气的物质的量为1mol,而由于氢元素由-1价变为0价,故当生成1mol氢气转移2mol电子即2NA个,故C正确;
D、铝离子是弱碱阳离子,在溶液中会水解,故溶液中的铝离子的个数小于0.1NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
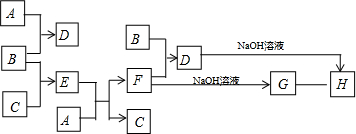
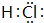 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、D两种元素形成的化合物中只含有极性键 | |
| B. | A、C、D三种元素形成的化合物一定是共价化合物,其溶液一定呈酸性 | |
| C. | 原子半径由大到小的顺序是F>E>C>D | |
| D. | 最高价氧化物对应水化物酸性最强的元素是C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学兴趣小组用如图所示装置进行电化学原理的实验探究,回答下列问题:
某化学兴趣小组用如图所示装置进行电化学原理的实验探究,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤⑨ | B. | ①③⑨ | C. | ③⑨⑩ | D. | ③⑦⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加盐酸,有能使澄清石灰水变浑浊的气体生成,则原溶液中有CO32- | |
| B. | 向某溶液中加石蕊试液,溶液变红,则原溶液中溶质是酸 | |
| C. | 向某溶液中加氢氧化钠溶液,生成蓝色沉淀,则原溶液中有Cu2+ | |
| D. | 向某溶液中加氯化钡溶液,生成白色沉淀,再加盐酸沉淀不溶解,则原溶液中有SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com