
| m |
| M |
| 480g |
| 60g/mol |


科目:高中化学 来源: 题型:
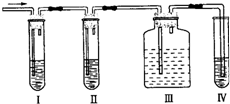 某混合气体可能是乙烯和二氧化硫的混合气,有人设计下列实验图以确认上述混合气体中有CH2=CH2和SO2.Ⅰ、Ⅱ、Ⅲ、Ⅳ装置中盛放的试剂依次是:品红溶液、NaOH溶液、品红溶液、酸性KMnO4溶液.回答下列问题:
某混合气体可能是乙烯和二氧化硫的混合气,有人设计下列实验图以确认上述混合气体中有CH2=CH2和SO2.Ⅰ、Ⅱ、Ⅲ、Ⅳ装置中盛放的试剂依次是:品红溶液、NaOH溶液、品红溶液、酸性KMnO4溶液.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | x | 2.0 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2.0 | 1.0 | 0.40 | 1.6 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3:2 | B、2:5 |
| C、3:5 | D、5:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、洗气或干燥装置:瓶内放一定体积溶液,由a进气 |
| B、用于收集氢气:瓶内充满水,由b进气 |
| C、排空气收集H2:瓶内充满空气,由a进气 |
| D、病人输氧时用于观察输氧速度:瓶内装适量水,b接病人鼻腔 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应是非氧化还原反应 |
| B、在理论上可以利用该反应的原理做成燃料电池 |
| C、该反应的热化学方程式为:B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=2 165 kJ?mol-1 |
| D、每生成18 g水,该反应转移2 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲、乙、丙、丁四种物质转化关系如图.已知甲是地壳中含量最高的元素组成的单质.
甲、乙、丙、丁四种物质转化关系如图.已知甲是地壳中含量最高的元素组成的单质.| 温度/℃ | 400 | 450 | 500 | 550 | 600 | 650 |
| 转化率/% | 99.2 | 97.5 | 93.5 | 85.6 | 73.7 | 58.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com