
【题目】已知A的产量通常用来衡量一个国家的石油化工水平,常用作水果催熟剂,现以A为主要原料合成一种具有果香味的物质E,其合成路线如图所示。

已知:醛可氧化生成羧酸。回答下列问题:
(1)写出下列物质的结构简式:A___;E___。
(2)写出下列反应的化学方程式,并注明反应类型:
①___、___;
②___、___;
④___、___;
(3)若想将B直接转化为D,可加入的物质为___。
【答案】CH2=CH2 CH3COOC2H5 CH2=CH2+H2O![]() CH3CH2OH 加成反应 2CH3CH2OH+O2
CH3CH2OH 加成反应 2CH3CH2OH+O2![]() 2CH3CHO+2H2O 氧化反应 CH3COOH+C2H5OH
2CH3CHO+2H2O 氧化反应 CH3COOH+C2H5OH![]() CH3COOC2H5+H2O 酯化反应 酸性高锰酸钾溶液
CH3COOC2H5+H2O 酯化反应 酸性高锰酸钾溶液
【解析】
A的产量通常用来衡量一个国家的石油化工水平,则A为CH2=CH2,CH2=CH2与水发生加成反应生成B为CH3CH2OH,CH3CH2OH在Cu或Ag作催化剂条件下,发生催化氧化生成C为CH3CHO,CH3CHO进一步氧化生成D为CH3COOH,CH3CH2OH被酸性高锰酸钾溶液或酸性重铬酸钾溶液可以直接氧化生成CH3COOH,CH3COOH与CH3CH2OH发生酯化反应生成E为CH3COOC2H5,据此解答。
(1)A为乙烯,含有碳碳双键,结构简式为CH2=CH2,E为乙酸乙酯,结构简式为CH3COOC2H5;
(2)反应①是乙烯与水发生加成反应生成乙醇,反应方程式为:CH2=CH2+H2O![]() CH3CH2OH,反应②是乙醇氧化反应生成乙醛,反应方程式为:2CH3CH2OH+O2
CH3CH2OH,反应②是乙醇氧化反应生成乙醛,反应方程式为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O,反应④是乙酸与乙醇发生酯化反应生成乙酸乙酯,反应方程式为:CH3COOH+C2H5OH
2CH3CHO+2H2O,反应④是乙酸与乙醇发生酯化反应生成乙酸乙酯,反应方程式为:CH3COOH+C2H5OH![]() CH3COOC2H5+H2O;
CH3COOC2H5+H2O;
(3)乙醇被酸性高锰酸钾溶液或酸性重铬酸钾溶液可以直接氧化生成乙酸。


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:
【题目】二甲醚被称为21世纪的新型燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上常采用甲醇气相脱水法来获取。其反应方程式为:2CH3OH(g)![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
完成下列填空:
28、有机物分子中都含碳元素,写出碳原子最外层电子的轨道表示式_______________;
写出甲醇分子中官能团的电子式_________________。
29、碳与同主族的短周期元素相比,非金属性较强的是_________(填元素符号)。写出一个能证明你的结论的化学方程式_____________________________________。
30、在温度和体积不变的情况下,能说明反应已达到平衡状态的是______(选填编号)
a.CH3OH的消耗速率与CH3OCH3的消耗速率之比为2:1
b.容器内压强保持不变
c.H2O(g)浓度保持不变
d.气体平均相对分子质量保持不变
31、一定温度下,在三个体积约为2.0 L的恒容密闭容器中发生上述反应:
容器 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.40 | 0.16 | 0.16 |
Ⅱ | 387 | 0.80 | a | |
Ⅲ | 207 | 0.40 | 0.18 | 0.18 |
(1)若要提高CH3OH的平衡转化率,可以采取的措施是______(选填编号)。
a.及时移走产物 b.升高温度 c.充入CH3OH d.降低温度
(2)I号容器内的反应经过t min达到平衡,则CH3OH的平均反应速率为_____________(用含t的式子表示)。II号容器中a =___________mol。
32、若起始时向容器I中充入CH3OH 0.2mol、CH3OCH3 0.30mol和H2O 0.20mol,则反应将向__________(填“正”“逆”)反应方向进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别向1L0.1mol·L-1MgCl2和MnCl2溶液中加入Na2CO3,固体(忽略体积变化),如图为加入Na2CO3的物质的量与-1gc(Mg2+)或-lgc(Mn2+)之间的关系,已知常温下Ksp(MgCO3)>Ksp(MnCO3),下列说法正确的是( )
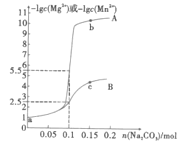
A.曲线A是n(Na2CO3)与-lgc(Mg2+)的关系曲线
B.Ksp(MnCO3)和Ksp(MgCO3)相差3个数量级
C.若将b点和c点溶液混合,存在![]() =1×106
=1×106
D.a点(MgCl2溶液)中存在:c(Mg2+)+c(H+)=c(OH-)+c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氮原子的最外层电子排布式是__;氮元素有多种化合价,列举一例含二种氮元素化合价的化合物__。
(2)肼(N2H4)分子可视为NH3分子的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。NH3分子的空间构型是__;与N2H4分子具有相同电子数的分子有多种,其中具有可燃性的物质是__(化学式)。
(3)肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)→3N2(g)+4H2O(g)+1038.7kJ,若该反应中有4molN-H键断裂,则形成的气体有__mol,其中转移电子数为__。
(4)肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在__(填标号)
a.离子键 b.共价键 c.金属键 d.范德华力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学的核心是发生化学反应,利用化学反应合成物质,同时也伴随有能量的变化,下列有关说法中不正确的是( )
A.只要发生化学反应就一定有能量变化
B.Zn+2HCl=ZnCl2+H2↑这是一个放热反应,结论:1molZn和2molHCl的能量之和高于1molZnCl2和1molH2的能量之和
C.反应A+B=C+D的能量变化如图所示,反应物A和B断裂化学键吸收总能量低于形成生成物C和D释放的总能量

D.发生化学反应实现了化学能和其他形式能量之间的相互转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,用0.1 mol·L-1NaOH溶液滴定某二元弱酸H2A,H2A被滴定分数、pH及物种分布分数δ[δ(X)=![]() ]如图所示:
]如图所示:
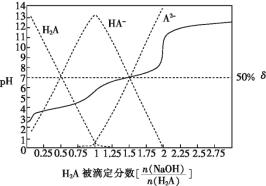
下列说法错误的是
A.用NaOH溶液滴定0.1 mol·L-1NaHA溶液可用酚酞作指示剂
B.0.1 mol·L-1Na2A溶液中:c(Na+)<c(HA-)+2c(A2-)
C.0.1 mol·L-1NaHA溶液中:c(Na+)>c(HA-)>c(H2A)>c(A2-)
D.H2A 的Ka2=1×10-7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用酸性蚀刻废液(含Cu2+、H+、CuC![]() 、Cl-等)和碱性蚀刻废液[N
、Cl-等)和碱性蚀刻废液[N![]() 、Cu(NH3
、Cu(NH3![]() 、NH3·H2O等]制备CuI(白色固体)的实验流程如下:
、NH3·H2O等]制备CuI(白色固体)的实验流程如下:

(1)步骤Ⅰ中发生了多个反应,其中Cu(NH3![]() 与盐酸反应生成Cu(OH)Cl的离子方程式为______。
与盐酸反应生成Cu(OH)Cl的离子方程式为______。
(2)步骤Ⅳ需控制pH为1~2,80 ℃下进行,合适的加热方式是______。
(3)步骤Ⅴ的具体步骤是蒸发浓缩、______、____。
(4)步骤Ⅵ在下列装置(夹持及加热装置已省略)中进行。

①装置a中盛装浓硫酸的仪器的名称是____,圆底烧瓶中发生反应的化学方程式为____。
②用装置d中的溶液洗涤制得的CuI的目的是____,然后再用无水乙醇洗涤的目的是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如下,该电池工作时反应为:4VB2+11O2=4B2O3 +2V2O5。下列说法不正确的是
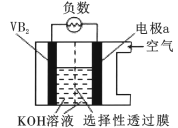
A. 电极a 为电池正极
B. 图中选择性透过膜为阴离子透过性膜
C. 电池工作过程中,电极a附近区域pH减小
D. VB2极发生的电极反应为:2VB2 +22OH--22e- = V2O5+2B2O3 + 11H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形。RCl5在气态和液态时,分子结构如下图所示,下列关于RCl5分子的说法中正确的是( )
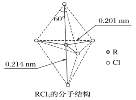
A. 每个原子都达到8电子稳定结构
B. 分子中5个R—Cl键键能不相同
C. 键角(Cl—R—Cl)有90°、120°、180°几种
D. RCl5受热后会分解生成分子RCl3,RCl5和RCl3都是极性分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com