
分析 (1)氧化还原反应中的,化合价升高值=化合价降低值=转移电子数目;化合价升高的元素被氧化,化合价降低的元素所在的反应物是氧化剂,据此回答;
(2)根据n=$\frac{m}{M}$计算Cu的物质的量,根据方程式计算NO、HNO3的物质的量,再根据V=nVm计算NO体积;
(3)使生成的Cu(NO3)2中Cu2+全部转化成沉淀,消耗氢氧根离子的物质的量是铜离子物质的量的2倍,据此回答.
解答 解:(1)该氧化还原反应中的,化合价升高的是铜元素,化合价降低的是硝酸中的氮元素,转移电子数为6mol,双线桥法表示电子转移的方向和数目为: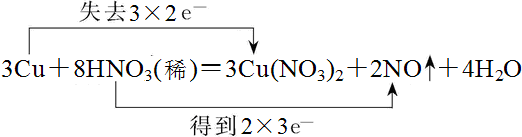 ,
,
故答案为: ;
;
(2)64gCu的物质的量为$\frac{6.4g}{64g/mol}$=0.1mol,
3 Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O
3 8 2
0.1 x y
所以x=$\frac{0.8}{3}$mol,y=$\frac{0.2}{3}$mol
标况下生成NO体积为$\frac{0.2}{3}$mol×22.4L/mol=1.49L,
答:标况下生成NO体积为1.49L;
(3)使生成的Cu(NO3)2中Cu2+全部转化成沉淀,消耗氢氧根离子的物质的量是铜离子物质的量的2倍,所以消耗氢氧化钠的物质的量是0.2mol,设需要质量分数为40%密度为1.42g/ml的NaOH溶液体积为VmL,即$\frac{1.42V×40%}{40}$=0.2,解得V=14mL,
答:至少需要质量分数为40%密度为1.42g/ml的NaOH溶液体积是14mL.
点评 本题考查了氧化还原反应电子转移和氧化还原反应的计算,难度中等,本题采取关系式计算,也可以利用电子转移守恒计算.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1L 1mol/LHF溶液中含HF分子数目为NA | |
| B. | 2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H=-a kJ•mol-1,将2mol CO2和6mol H2在一密闭容器中按照上述反应充分反应放出a kJ的热量 | |
| C. | 78gNa2O2固体中含阴离子数目为NA | |
| D. | 25g质量分数68%的H2O2水溶液中含氧原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
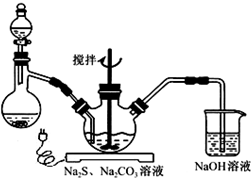 NaCN为剧毒无机物.某化学兴趣小组查阅资料得知,实验室里的氰化钠溶液可使用硫代硫酸钠溶液进行统一解毒销毁,他们开展了以下三个实验,根据要求回答问题:
NaCN为剧毒无机物.某化学兴趣小组查阅资料得知,实验室里的氰化钠溶液可使用硫代硫酸钠溶液进行统一解毒销毁,他们开展了以下三个实验,根据要求回答问题:
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 A、B、C、D、E五种物分别是NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:
A、B、C、D、E五种物分别是NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(S) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) mol | 0.200 | c1 | 0.10 | c3 | a | b |
| n(NO2) mol | 0.000 | 0.120 | c2 | 0.240 | 0.240 | 0.240 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com